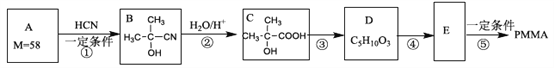
题目内容
【题目】—定条件下,CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
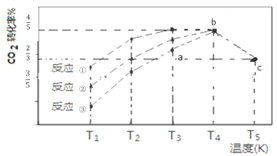
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2![]() L-2)
L-2)
【答案】A
【解析】a要达到平衡,CO2的转化率增大,反应正向进行,所以 v(正)>v(逆),故A正确;b点反应达到平衡状态,参加反应的CO2小于1mol,反应放热小于53.7 kJ,故B错误;相同温度下,反应①最快,所以催化剂效果最佳的反应是①,故C错误;c点CO2的转化率是![]() ,
,
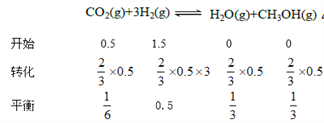 ,
,
K=8/3(mol-2![]() L-2),故D错误。
L-2),故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。