题目内容
15.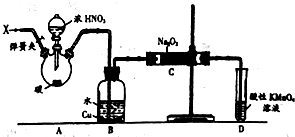 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.已知:室温下,①2NO+Na2O2═2NaNO2
②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO${\;}_{2}^{-}$都能与MnO${\;}_{4}^{-}$反应生成NO${\;}_{3}^{-}$和Mn2+
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡.则X为氮气,上述操作的作用是排尽空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)B中观察到的主要现象是红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝.
(3)A烧瓶中反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)D装置中反应的离子方程式3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O.
(5)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和NaOH.为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为碱石灰.
(6)利用改进后的装置,将3.12g Na2O2完全转化成为NaNO2,理论上至少需要木炭0.72g.
分析 A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
(1)一氧化氮容易与空气中的氧气反应生成二氧化氮;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,据此描述反应现象;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水;
(4)除去未反应的NO,防止污染空气,酸性条件下高锰酸钾氧化一氧化氮为硝酸盐,本身被还原为锰离子;
(5)一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应除去二氧化碳和水蒸气;
(6)根据发生的反应①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算.
解答 解:(1)A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,为防止装置中空气中的氧气氧化生成的一氧化氮,应先通入氮气排尽装置内的空气,
故答案为:氮气;排尽空气,以免生成的一氧化氮被空气中的氧气氧化;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,所以会看到的现象为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
故答案为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)D装置中高锰酸钾氧化一氧化氮生成硝酸根,本身被还原为二价锰离子,离子方程式:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
故答案为:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
(5)一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加盛有碱石灰的装置E,碱石灰能够吸收二氧化碳和水蒸气;
故答案为:NaOH;碱石灰;
(6)n(Na2O2)=$\frac{3.12g}{78g/mol}$=0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为nmol,根据C+4HNO3(浓) $\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O知生成4nmolNO2,根据3NO2+H2O=2HNO3+NO可知4nmolNO2与水反应生成4nmol×$\frac{2}{3}$=$\frac{8}{3}$nmol硝酸和$\frac{4}{3}$nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知硝酸与铜反应生成的NO为$\frac{8}{3}$nmol×$\frac{2}{8}$=$\frac{2}{3}$nmol,所以$\frac{4}{3}$nmol+$\frac{2}{3}$nmol=2nmol=0.08mol,得n=0.04mol,则C的质量=12g/mol×0.04mol=0.48g,
故答案为:0.48.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,掌握物质的性质是解题关键,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
| A. | CH3CH2CH2CH3 | B. |  | C. | CH3CH2CH3 | D. |  |
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可以用嘴吮吸铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室放置数盆清水,这样可有效的吸收CO,防止煤气中毒 | |
| C. | 汽水浇灌农田有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用 | |
| D. | 纯碱又名烧碱,成分是氢氧化钠 |
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| C. | Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |




 .
.
 在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.
在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO${\;}_{4}^{-}$+5C2O${\;}_{4}^{2-}$+16H+$\frac{\underline{\;75℃-85℃\;}}{\;}$2Mn2+(溶液无色)+10CO2↑+8H2O.