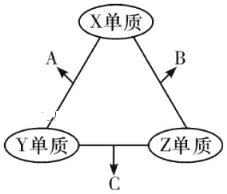
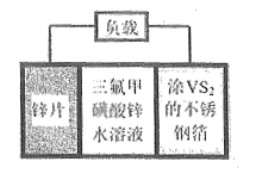
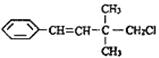
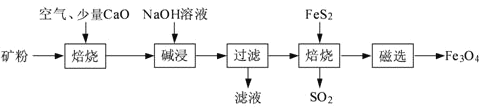
题目内容
【题目】(1)分别写出下列物质的电子式:
N2______________ NaOH______ H2O2_________
(2)写出下列反应的化学方程式:
硅单质与氢氧化钠溶液的反应:_________。
二氧化氮与水反应:___________。
铜和浓硫酸加热反应:___________ 。
【答案】![]()
![]()
![]() Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑ 3NO2 + H2O =2HNO3 + NO Cu + 2H2SO4 = CuSO4 + SO2↑+ 2H2O
Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑ 3NO2 + H2O =2HNO3 + NO Cu + 2H2SO4 = CuSO4 + SO2↑+ 2H2O
【解析】
(1)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为![]() ;
;
氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,电子式为![]() ;
;
双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:![]() ;
;
(2)单质硅与氢氧化钠溶液反应,硅被氧化,氢被还原,生成Na2SiO3和氢气,反应的化学方程式为:Si + 2NaOH + H2O =Na2SiO3+ 2H2↑;
二氧化氮与水反应生成硝酸和NO,反应的化学方程式为3NO2+ H2O =2HNO3+ NO;
Cu与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的化学方程式为Cu + 2H2SO4= CuSO4+ SO2↑+ 2H2O。

【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O![]() H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=-159.5kJmol-1;
NH2CO2NH4(s) △H1=-159.5kJmol-1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJmol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
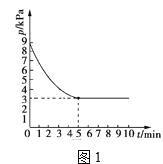
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。
【题目】(1)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
①已知反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
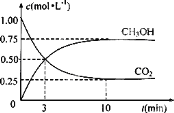
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为_________。
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。(M(尿素)=60g/mol)
①T1℃时,该反应的平衡常数K的值为______。
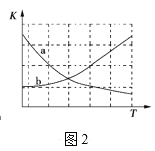
②图2中能正确反映平衡常数K随温度变化关系的曲线为____(填曲线标记字母)