��Ŀ����
����Ŀ����1�����Ŵ�����Ⱦ���������أ�����������ʮ�������ڼ䣬����������(SO2)�ŷ�������8%����������(NOx)�ŷ��Լ���10%��������̼(CO2)���ŷ���ҲҪ������١�
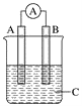
����֪��Ӧ��NO2(g)+SO2(g)![]() SO3(g)+NO(g)��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����____(����ĸ)��
SO3(g)+NO(g)��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����____(����ĸ)��
A����ϵѹǿ���ֲ���
B�����������ɫ���ֲ���
C����������ƽ����Է����������ٱ仯
D��ÿ����1molSO3��ͬʱ����1 molNO2
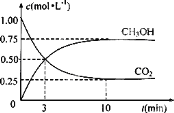
��CO2��ת�����л��� CH3OHʵ��̼ѭ������1L���ܱ������У�����lmolCO2�� 3molH2��һ�������·�Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)=_______
CH3OH(g)+H2O(g)���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)=_______
�۹�ҵ�ϣ�CH3OH Ҳ����CO��H2�ϳɡ��ο��ϳɷ�ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ�ⳣ��������˵����ȷ����_____����˫ѡ��
CH3OH(g)��ƽ�ⳣ��������˵����ȷ����_____����˫ѡ��
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
A���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ
B���÷�Ӧ�ڵ����²����Է����У������¿��Է�����
C����T��ʱ��1L�ܱ�������Ͷ��0.1molCO�� 0.2molH2���ﵽƽ��ʱ��COת����Ϊ 50%�����ʱ��ƽ�ⳣ��Ϊ100
D����ҵ�ϲ����Ըߵ�ѹǿ(5MPa)��250�棬����Ϊ�������£�ԭ����ת�������
��2����NH3��CO2Ϊԭ�Ͽ��Ժϳ�����[CO(NH2)2]���漰�Ļ�ѧ��Ӧ���£�
��ӦI��2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ��H1=159.5 kJ��mol1��
NH2CO2NH4(s) ��H1=159.5 kJ��mol1��
��ӦII��NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ��H2=+116.5 kJ��mol1��
CO(NH2)2(s)+H2O(g) ��H2=+116.5 kJ��mol1��
![]() H2O(g) ��H3=+44.0 kJ��mol1��
H2O(g) ��H3=+44.0 kJ��mol1��
��ӦIV��NH3��CO2�ϳ�����ͬʱ����Һ̬ˮ���Ȼ�ѧ����ʽΪ_________��
��3��T1��ʱ�����ݻ�Ϊ2L�ĺ����ܱ������г���n(NH3)��n(CO2)=2��1��ԭ������ʹ֮������ӦIV����Ӧ������õ����ص�����Ϊ30g�������ڵ�ѹǿ(p)��ʱ��(t)�ı仯��ͼ1��ʾ����M(����)=60g/mol��
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K��ֵΪ______��
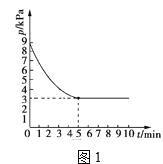
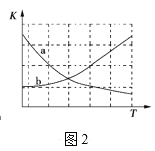
��ͼ2������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ____�������߱����ĸ��
���𰸡�B 0.225mol��L��1��min��1 AC 2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) ��H��87.0 kJ��mol1 128(mol/L)-3 a
CO(NH2)2(s)+H2O(l) ��H��87.0 kJ��mol1 128(mol/L)-3 a
��������
(1)�ٴﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣻
�ڸ���v=![]() �����v(CH3OH)��Ȼ���������֮�ȵ��ڻ�ѧ������֮�����v(H2)��
�����v(CH3OH)��Ȼ���������֮�ȵ��ڻ�ѧ������֮�����v(H2)��
��A���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС�����淴Ӧ���淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���B��������G=��H-T��S�жϣ���G��0����Ӧ�����Է����У���G��0����Ӧ�Է����У�C����������ʽ�����ƽ��ʱƽ���������ֵ�Ũ�ȣ�����ƽ�ⳣ���ı���ʽ���㣻D���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС�����淴Ӧ���淴Ӧ�ƶ���������ԭ����ת����
(2)��д��NH3��CO2�ϳ�����ͬʱ����Һ̬ˮ�Ļ�ѧ����ʽΪ2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)�����ݸû�ѧ����ʽ�����ø�˹����I+II-III�õ�NH3��CO2�ϳ�����ͬʱ����Һ̬ˮ���Ȼ�ѧ����ʽ��
(3)��ƽ�ⳣ����������Ũ���ݻ��뷴Ӧ��Ũ���ݻ�֮�ȣ���Ӧ������õ����ص����ʵ���Ϊ![]() =0.5mol�����÷�Ӧ������ʽ�����ƽ��ʱc(NH3)��c(CO2)���������ƽ�ⳣ������ʽ���ƽ�ⳣ��K��ֵ��
=0.5mol�����÷�Ӧ������ʽ�����ƽ��ʱc(NH3)��c(CO2)���������ƽ�ⳣ������ʽ���ƽ�ⳣ��K��ֵ��
�ڷ�Ӧ IVΪ2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)��H=-87.0kJmol-1���÷�Ӧ������ȣ�����ƽ�ⳣ��kֻ���¶��йأ����������¶ȣ���Ӧ�����ƶ���
(1)��A�������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬����A����B�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬����B��ȷ��C�����������������������ʵ����������Ƿ�ﵽƽ�⣬���߾�ʼ�ձ��ֲ��䣬���������ƽ����Է�������ʼ�ղ��䣬�����ж��Ƿ�ﵽƽ��״̬����C����D�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO3��ͬʱ����1molNO2�������ж��Ƿ�ﵽƽ��״̬����D���ʴ�ΪB��
����ͼ���֪��v(CH3OH)=![]() =0.075 mol��L��1��min��1��v(H2)=3v(CH3OH)=0.225mol��L��1��min��1��
=0.075 mol��L��1��min��1��v(H2)=3v(CH3OH)=0.225mol��L��1��min��1��
��A���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС�����淴Ӧ���淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ����A��ȷ��B����ӦΪ���ȷ�Ӧ��H��0����G=��H-T��S��0������S��0ʱ����Ӧ���Է����У��Ҹ��º͵����£��������Է����У���B����
C�����ڿ��淴Ӧ��CO(g)+2H2(g)CH3OH(g)
��ʼ(mol/L) 0.1 0.2 0
�仯(mol/L) 0.05 0.1 0.05
ƽ��(mol/L) 0.05 0.1 0.05
����ƽ�ⳣ��k=![]() ==100����C��ȷ��D������ѹǿ��ƽ��������Ӧ�ƶ���������ԭ����ת�����ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС�����淴Ӧ���淴Ӧ�ƶ��������߲�����ԭ����ת������ȡ250���¶ȣ����Ƿ�Ӧ����������Ļ��ԣ���D���ʴ�ΪAC��
==100����C��ȷ��D������ѹǿ��ƽ��������Ӧ�ƶ���������ԭ����ת�����ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС�����淴Ӧ���淴Ӧ�ƶ��������߲�����ԭ����ת������ȡ250���¶ȣ����Ƿ�Ӧ����������Ļ��ԣ���D���ʴ�ΪAC��
(2)NH3��CO2�ϳ�����ͬʱ����Һ̬ˮ�Ļ�ѧ����ʽΪ2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)�����ݸ�˹����I+II-III�У�2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)��H=-159.5kJmol-1+(+116.5kJmol-1)-(+44.0kJmol-1)=-87.0kJmol-1��
(3)������ʼn(CO2)=x����n(NH3)=2x��ƽ��ʱ�������ص����ʵ���Ϊ![]() =0.5mol����ӦIV������ʽΪ
=0.5mol����ӦIV������ʽΪ
2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)
��ʼ��(mol) 2x x 0
�仯��(mol)1 0.5 0.5
ƽ����(mol)
���ݺ��º��������£���������ʵ���֮�ȵ���ѹǿ֮����3x��(2x-1+x-0.5+0.5)=9��3��x=0.75mol��ƽ��ʱc(NH3)=![]() =0.25mol/L��c(CO2)=0.125mol/L��ƽ�ⳣ��k=
=0.25mol/L��c(CO2)=0.125mol/L��ƽ�ⳣ��k=![]() =
=![]() =128��
=128��
��2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)��H=-87.0kJmol-1���÷�Ӧ������ȣ����������¶ȣ���Ӧ�����ƶ���k��С����ƽ�ⳣ��k���¶����߶���С���ʴ�Ϊa��