题目内容
【题目】下列说法说法正确的是
A.外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
B.向Na2CO3溶液中加入少量BaCl2固体,CO32-水解程度增大,溶液的pH减小
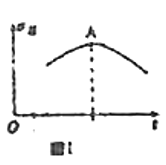
C.如图表示常温下稀释pH=11的NaOH溶液和氨水时溶液pH的变化,曲线Ⅱ表示氨水
D.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
【答案】B
【解析】
A.外接电源保护水中钢闸门时,应将钢闸门与电源的负极相连,故A错误;
B.Na2CO3溶液中,由于碳酸根离子水解使溶液显碱性,向溶液中加入少量BaCl2固体,CO32-与Ba2+结合形成碳酸钡沉淀,碳酸根离子的浓度减小, CO32-水解程度增大,浓度的影响更显著,溶液中氢氧根离子浓度减小,溶液的pH减小,故B正确;
C.等pH的强碱与弱碱,稀释相同倍数时,强碱的pH变化大,弱碱存在电离平衡,则图中Ⅰ表示氨水稀释的情况,故C错误;
D.根据反应,正反应为熵减的反应,即△S<0,常温下能自发进行,根据△HT△S=△G<0反应自发进行,可推知该反应△H<0,故D错误;
答案选B。

练习册系列答案
相关题目
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜