题目内容
【题目】元素铈(Ce)是一种重要的稀土元素。
(1) 工业上用氟碳铈矿(主要成分为CeFCO3)制备CeO2。焙烧过程中发生的主要反应的化学方程式为________。

(2) 已知CeCl3·7H2O在空气中易被氧化成四价铈,反应如下:
① CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
② 4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③ Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=________。
(3) CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如图1所示。写出过程1发生反应的化学方程式:________________________________。

(4) 已知Ce(OH)4极易分解,用如图2所示装置电解CeCl3溶液在阴极区制得CeO2。电解过程中反应体系的pH随时间t的变化曲线如图3所示。
①电解进行1h内溶液的pH迅速下降,可能原因是________。
②请解释生成CeO2的原理:________。
(5) 常温下,当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全。用Na2C2O4溶液对电解后的废液处理得到Ce2(C2O4)3固体,则应保持溶液中c(C2O42-)约为________。(已知25 ℃时,Ksp[Ce2(C2O4)3]=1.0×10-25)
【答案】4CeFCO3+4NaHCO3+O2 ![]() 4NaF+4CeO2+8CO2+2H2O (4a+b+4c) kJ·mol-1 xCO+CeO2=CeO(2-x)+xCO2 产生的Cl2发生反应Cl2+H2OHCl+HClO。由于生成了HCl,使反应体系的pH迅速下降 阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,然后再分解生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2] 1.0×10-5 mol·L-1
4NaF+4CeO2+8CO2+2H2O (4a+b+4c) kJ·mol-1 xCO+CeO2=CeO(2-x)+xCO2 产生的Cl2发生反应Cl2+H2OHCl+HClO。由于生成了HCl,使反应体系的pH迅速下降 阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,然后再分解生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2] 1.0×10-5 mol·L-1
【解析】
(1)焙烧过程中,CeFCO3和加入的NaHCO3反应转化生成CeO2和二氧化碳,焙烧过程O2参加反应,根据物料守恒和得失电子守恒写出主要反应的方程式;
(2)利用盖斯定律,分析计算目标反应焓变;
(3)过程1中,CeO2和一氧化碳反应生成二氧化碳CeO(2-x),据此书写方程式;
(4)根据电解过程中阴阳极电极上的产物分析;
(5)利用溶度积常数计算公式进行计算。
(1)焙烧过程中,CeFCO3和加入的NaHCO3反应转化生成CeO2和二氧化碳,焙烧过程O2参加反应,根据物料守恒和得失电子守恒,主要反应的方程式为:4CeFCO3+4NaHCO3+O2 ![]() 4NaF+4CeO2+8CO2+2H2O;
4NaF+4CeO2+8CO2+2H2O;
(2)已知:①CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
②4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则根据盖斯定律:①×4+②+③×4,可得4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=(4a+b+4c) kJ·mol-1;
(3)根据图1所示,过程1中CeO2和一氧化碳反应生成二氧化碳CeO(2-x),根据物料守恒,化学反应方程式为:xCO+CeO2=CeO(2-x)+xCO2;
(4) ①如图2所示装置,电解CeCl3溶液,阳极上电解质溶液中氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2,产生的Cl2与电解液中的水反应生成盐酸和次氯酸,反应方程式为:Cl2+H2OHCl+HClO,使电解质溶液酸性增强,pH减小;
②电解CeCl3溶液在阴极区制得CeO2,电解过程中,Ce的化合价升高,被氧化,结合(4)中分析,阳极电解产生的Cl2把Ce3+氧化成Ce4+。同时与阴极电解产生OH-离子反应生成Ce(OH)4,结合已知信息,Ce(OH)4极易分解,生成CeO2[或者Ce3+与阴极电解产生的OH-反应生成Ce(OH)3,Ce(OH)3再被阳极电解产生的Cl2氧化成Ce(OH)4,然后再分解生成CeO2];
(5) 当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全,则Ce3+完全沉淀时,溶液中c(Ce3+)= 1.0×10-5mol/L,Ksp[Ce2(C2O4)3]=c2(Ce3+) c3(C2O42-)=1.0×10-25,则c(C2O42-)=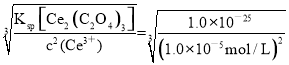 = 1.0×10-5 mol·L-1。
= 1.0×10-5 mol·L-1。

【题目】在一定条件下有反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是:
A. Q1<197
B. 在上述条件下,反应生成1molS03气体放热98.5kJ
C. Q2=Q3
D. Q3<Q1<2Q2
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L