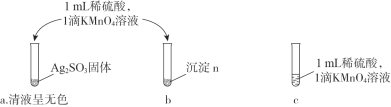
题目内容
【题目】有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈淡蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4。
(1)B、C、E 三元素组成的化合物之一,是家用消毒剂的主要成分,所含的化学键有______,其电子式为______。
(2)D、E、F 的简单离子半径由大到小的顺序是_________(用离子符号表示)。
(3)两种均含A、B、C、F 四种元素的化合物在溶液中相互反应的离子方程式__。
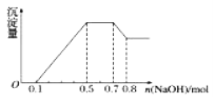
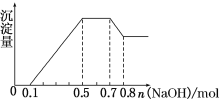
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n) 与反应时间(t)的曲线如图所示。
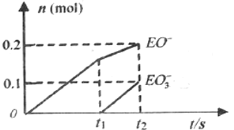
则t2时刻消耗氢氧化钙质量为______g,此时反应的化学方程为______。
(5)A、B 形成的化合物BA 在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物,写出它与乙醇的化学方程式:_________________________。
【答案】离子键、共价键 ![]() S2->Cl->Al3+ H++HSO3-=SO2+H2O 37 10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O NaH+CH3CH2OH=CH3CH2ONa+H2↑
S2->Cl->Al3+ H++HSO3-=SO2+H2O 37 10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O NaH+CH3CH2OH=CH3CH2ONa+H2↑
【解析】
A 的一种原子不含中子,A是H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,B是Na元素;C元素的一种气体单质呈淡蓝色,C是O元素;D与B同周期,该周期中D的简单离子半径最小,D是Al元素;E的单质是一种本身有毒可以用来消毒的气体,E是Cl元素;F 元素最高正价与最低负价的代数和为4,F是S元素。
(1)Na、O、Cl 三元素组成的化合物之一,是家用消毒剂的主要成分,该化合物是NaClO,所含的化学键有离子键、共价键,其电子式为![]() 。
。
(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小,Al、Cl、S的简单离子半径由大到小的顺序是S2->Cl->Al3+。
(3)两种均含H、Na、O、S 四种元素的化合物是NaHSO4和NaHSO3,在溶液中相互反应生成硫酸钠、二氧化硫、水,反应的离子方程式是H++HSO3-=SO2+H2O。
(4)根据图示,则t2时刻生成ClO-、ClO3-的物质的量分别是0.2mol、0.1mol,根据得失电子守恒生成Cl-的物质的量是0.2mol×1+0.1mol×5=0.7mol,根据电荷守恒,溶液中Ca2+的物质的量是(0.7mol+0.2mol+0.1mol)÷2=0.5mol,消耗氢氧化钙质量为0.5mol ×74g/mol=37g,反应生成的CaCl2、Ca(ClO)2、Ca(ClO3)2的比为7:2:1,此时反应的化学方程为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O。
(5)H、Na 形成的化合物是NaH,NaH与乙醇反应生成乙醇钠和氢气,反应的化学方程式为NaH+CH3CH2OH=CH3CH2ONa+H2↑。

 阅读快车系列答案
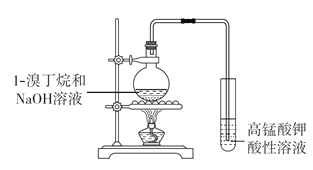
阅读快车系列答案【题目】某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
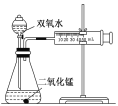
分析表中数据回答下列问题:
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是__________________________________。
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有_____。(回答任意两个合理的措施)
【题目】以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g) + 2H2(g) ![]() CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物发生反应I,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
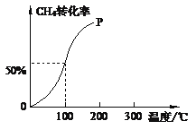
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的反应速率为______。
②100℃时反应I的平衡常数为____________。
(3)若在恒温恒压容器内进行反应II,下列能说明该反应达到平衡状态的有________(填序号)。
A.有2个H—H键生成的同时有 3个C—H键断裂
B.CO百分含量保持不变
C.容器中混合气体的压强保持不变
D.容器中混合气体的密度保持不变
(4)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是__________(填序号)。
A.c(H2) 减少 B.正反应速率加快,逆反应速率减慢
C.n(CH3OH) 增加 D.![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大