题目内容
维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告.(请填写空白)
测定目的:测定××牌软包装橙汁中维生素C的含量.
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
实验用品及试剂;试剂:指示剂(1) (填名称),浓度为7.50×10-3mol/L的I2标准溶液、蒸馏水等.
实验过程
洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
用酸式滴定管向锥形瓶中移入25.00mL待测橙汁,滴入2滴指示剂.
用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视(2) ,直到滴定终点.滴定至终点时的现象是(3) .
数据记录与处理.某同学滴定时记录的数据如下:
则此橙汁中维生素C的含量是(4) mg/L.
(5)问题讨论:(填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果 .
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,会使测定结果 .
③读数时,滴定前仰视,滴定后俯视,会使测定结果 .
④装I2标准溶液之前,没有用标准液润洗滴定管,会使测定结果 .
测定目的:测定××牌软包装橙汁中维生素C的含量.
测定原理:C6H8O6+I2→C6H6O6+2H++2I-(待测橙汁中其他物质不与I2反应)
实验用品及试剂;试剂:指示剂(1)
实验过程
洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
用酸式滴定管向锥形瓶中移入25.00mL待测橙汁,滴入2滴指示剂.
用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视(2)
数据记录与处理.某同学滴定时记录的数据如下:
| 实验编号 | 待测橙汁的体积/mL | 滴定完成时,消耗I2标准溶液的体积/mL |
| 1 | 25.00 | 14.93 |
| 2 | 25.00 | 15.10 |
| 3 | 25.00 | 14.97 |
(5)问题讨论:(填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,会使测定结果
③读数时,滴定前仰视,滴定后俯视,会使测定结果
④装I2标准溶液之前,没有用标准液润洗滴定管,会使测定结果
考点:中和热的测定
专题:实验题
分析:(1)根据碘遇淀粉,溶液变蓝选择试剂;
(2)眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点;
(3)根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应
(4)根据反应原理及题中有关数据,利用方程式,可以计算出橙汁中维生素C的含量;
(5)根据标准液的体积偏大,测定结果偏大,反之偏小;
①用蒸馏水冲洗锥形瓶,待测液溶质的物质的量不变;
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,导致消耗的标准液偏大;
③读数时,滴定前仰视,滴定后俯视,导致消耗的标准液偏小;
④装I2标准溶液之前,没有用标准液润洗滴定管,溶液变稀,导致消耗的标准液偏大.
(2)眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点;
(3)根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应
(4)根据反应原理及题中有关数据,利用方程式,可以计算出橙汁中维生素C的含量;
(5)根据标准液的体积偏大,测定结果偏大,反之偏小;
①用蒸馏水冲洗锥形瓶,待测液溶质的物质的量不变;
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,导致消耗的标准液偏大;
③读数时,滴定前仰视,滴定后俯视,导致消耗的标准液偏小;
④装I2标准溶液之前,没有用标准液润洗滴定管,溶液变稀,导致消耗的标准液偏大.
解答:
解:(1)利用I2氧化维生素C,碘遇淀粉,溶液变蓝,应选择淀粉作指示剂,
故答案为:淀粉溶液;
(2)滴定时,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点;
故答案为:锥形瓶中溶液颜色的变化;
(3)根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:溶液由无色变为蓝色,且半分钟内不褪色;
(4)经数据处理,取另三次实验的平均值,则在实验中消耗的标准碘溶液的体积应该是
ml=15ml,15ml标准碘溶液含有碘的质量为:254g/mol×0.015L×7.5×10-3mol?L-1=28.575mg,设20.0mL待测橙汁中维生素C的质量为X
C6H8O6 +I2→C6H6O6+2H++2I-
176 254
X 28.575mg
=
,解得:X=19.8mg
则1L中含维生素C的质量为:19.8mg×1000ml/25ml=792mg,所以,则此橙汁中维生素C的含量是792mg/L;
故答案为:792.00;
(5)①用蒸馏水冲洗锥形瓶,待测液溶质的物质的量不变,标准液体积不变,无影响;
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,导致消耗的标准液偏大,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,导致消耗的标准液偏小,测定结果偏低;
④装I2标准溶液之前,没有用标准液润洗滴定管,溶液变稀,导致消耗的标准液偏大,测定结果偏高;
故答案为:无影响,偏高,偏低,偏高.
故答案为:淀粉溶液;
(2)滴定时,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点;
故答案为:锥形瓶中溶液颜色的变化;
(3)根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:溶液由无色变为蓝色,且半分钟内不褪色;
(4)经数据处理,取另三次实验的平均值,则在实验中消耗的标准碘溶液的体积应该是
| 14.93+15.10+14.97 |
| 3 |
C6H8O6 +I2→C6H6O6+2H++2I-
176 254
X 28.575mg
| 176 |
| 254 |
| X |
| 28.575mg |
则1L中含维生素C的质量为:19.8mg×1000ml/25ml=792mg,所以,则此橙汁中维生素C的含量是792mg/L;
故答案为:792.00;
(5)①用蒸馏水冲洗锥形瓶,待测液溶质的物质的量不变,标准液体积不变,无影响;
②在滴定过程中不慎将数滴I2标准溶液滴在锥形瓶外,导致消耗的标准液偏大,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,导致消耗的标准液偏小,测定结果偏低;
④装I2标准溶液之前,没有用标准液润洗滴定管,溶液变稀,导致消耗的标准液偏大,测定结果偏高;
故答案为:无影响,偏高,偏低,偏高.
点评:本题借助氧化还原滴定测定橙汁中维生素C的含量,完成本题时要注意题中数据的处理,实验原理,合理进行误差的分析等,难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列物质中,不属于合金的是( )
| A、硬铝 | B、水银 | C、钢铁 | D、黄铜 |
下列反应中反应物的总能量小于生成物的总能量的是( )
| A、电解水制取H2和O2 |
| B、甲烷燃烧 |
| C、铝粉与氧化铁粉末反应 |
| D、油脂在人体内完全氧化生成CO2和H2O |
有Na2CO3、NaHCO3、CaO和NaOH组成的混合物28.2g,把它们溶于足量的水,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将容器中的水分蒸干,最后得到白色固体物质共30g.则下列有关叙述错误的是( )
| A、原混合物中含Na2CO3 0.1mol |
| B、原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO) |
| C、30g固体中一定存在n(CaCO3)>n(NaOH) |
| D、不能确定原混合物中NaOH的质量 |
下列措施中,能减慢化学反应速率的是( )
| A、食物储存在冰箱里 |
| B、将块状固体药品研细后再反应 |
| C、用MnO2作H2O2分解反应的催化剂 |
| D、用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
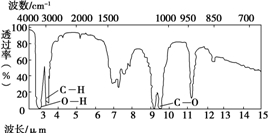 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题: