题目内容
将0.1mol/L的稀盐酸滴加到250mL碳酸钠溶液中,生成了4.48L的二氧化碳气体(气体体积在标准状况下测定).
(1)求此碳酸钠溶液的物质的量浓度
(2)需滴加多少体积的稀盐酸?
(1)求此碳酸钠溶液的物质的量浓度
(2)需滴加多少体积的稀盐酸?
考点:化学方程式的有关计算
专题:计算题
分析:稀盐酸滴加到碳酸钠溶液中,发生Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,n(CO2)=
=0.2mol,以此计算.
| 4.48L |
| 22.4L/mol |
解答:
解:稀盐酸滴加到碳酸钠溶液中,发生Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,
(1)n(CO2)=
=0.2mol,由C原子守恒可知,n(CO2)=n(Na2CO3)=0.2mol,c(Na2CO3)=
=0.8mol/L,
答:此碳酸钠溶液的物质的量浓度为0.8mol/L;
(2)由反应可知,消耗n(HCl)=2n(CO2)=0.4mol,则V(盐酸)=
=4L,
答:需滴加4L的稀盐酸.
(1)n(CO2)=
| 4.48L |
| 22.4L/mol |
| 0.2mol |
| 0.25L |
答:此碳酸钠溶液的物质的量浓度为0.8mol/L;
(2)由反应可知,消耗n(HCl)=2n(CO2)=0.4mol,则V(盐酸)=
| 0.4mol |
| 0.1mol/L |
答:需滴加4L的稀盐酸.
点评:本题考查化学反应方程式的计算,把握发生的化学反应及反应中物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意反应的先后顺序,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列表示对应化学反应的离子方程式或化学方程式正确的是( )
| A、向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-═NH3?H2O+BaSO4↓+H2O | ||||
| B、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+O2↑ | ||||
C、用铜作电极电解饱和食盐水:2Cl-+2H2O
| ||||
D、以下有机物在碱性条件下水解的化学方程式:BrCH2-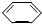 -OOCH+3NaOH -OOCH+3NaOH
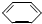 ONa+HCOONa+NaBr ONa+HCOONa+NaBr |
 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为: ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n].该化合物为高强度纤维材料,其结构简式为
,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n].该化合物为高强度纤维材料,其结构简式为 分析化学中常用X射线研究晶体结构.
分析化学中常用X射线研究晶体结构.