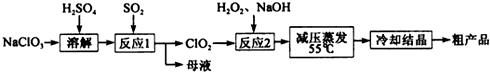
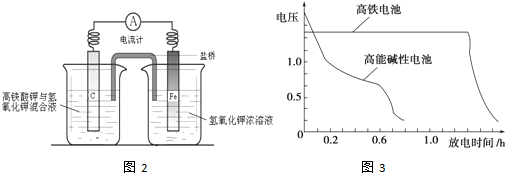
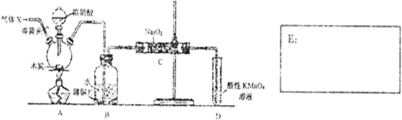
题目内容
16.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是( )| A. | Na2SO3溶液【Ba(OH)2溶液】 | B. | FeCl2溶液【KSCN溶液】 | ||
| C. | KI【淀粉溶液】 | D. | NaOH溶液【Ba(OH)2溶液】 |
分析 A.Na2SO3和Ba(OH)2反应生成沉淀;
B.硫酸铁与KSCN发生颜色反应
C.淀粉遇碘单质变蓝色;
D.氢氧化钠变质生成碳酸钠,可与氢氧化钡反应生成沉淀.
解答 解:A.Na2SO3和Ba(OH)2反应生成沉淀,应加入盐酸酸化后再加入Ba(OH)2,故A错误;
B.硫酸铁溶液在空气中被氧化生成硫酸铁,硫酸铁与KSCN发生颜色反应,可鉴别,故B正确;
C.淀粉遇碘单质变蓝色,与碘化钾不变色,可检验,故C正确;
D.氢氧化钠变质生成碳酸钠,可与氢氧化钡反应生成沉淀,可鉴别,故D正确.
故选A.
点评 本题综合考查化学实验方案的评价,涉及元素化合物知识,侧重于考查化学知识的综合应用,有利于培养学生良好的科学素养,题目难度不大,注意相关物质的性质以及实验方案的评价.

练习册系列答案
相关题目
1.下列与金属腐蚀有关的说法正确的是( )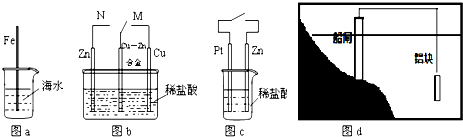

| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 图d中,船闸采用的是牺牲阴极的阳极保护法 |
8.设NA为阿伏加德罗常数,下列正确的是( )
| A. | 1 mol 过氧化钠中阴离子所带的负电荷数为NA | |
| B. | mg${\;}_{Z}^{A}$Xn-中所含电子总数为(Z+n)m$\frac{N_A}{A}$ | |
| C. | 100mL 0.1mol•L-1的稀醋酸中含有H+个数为0.01NA | |
| D. | 11.2L CO2所含的原子个数为1.5NA |
5.下列有关实验的说法正确的是( )
| A. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 | |
| C. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并搅拌均匀 | |
| D. | 为减小溶液配制误差,容量瓶必须洗净并烘干后才能使用 |
6.如表是元素周期的一部分,出了七种元素的周期表中的位置:
请用化学符号按要求回答下列问题:
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是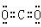
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是
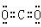
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.