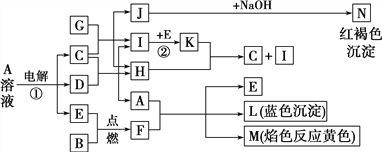
题目内容
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化剂
C.H2C2O4在反应中被氧化 D.1 mol KClO3参加反应有2 mol电子转移
【答案】C
【解析】
试题分析:在实验室制得ClO2的反应 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O中,A.KClO3中的Cl在反应中元素的化合价降低,得到电子被还原,错误;B.还原产物ClO2,错误;C.H2C2O4中的C在反应中元素的化合价升高,失去电子,被氧化,变为CO2,正确;D.每有1 molKClO3参加反应有1mol电子转移,错误。

【题目】下表是部分城市某日空气质量日报:
城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
SO2 | NO2 | PM10 | |||
A | 98 | 23 | 67 | SO2 | Ⅱ |
B | 47 | 29 | 35 | SO2 | Ⅰ |
C | 62 | 80 | 113 | PM10 | Ⅲ |
D | 52 | 76 | 59 | NO2 | Ⅰ |
(1) 由上表可知,空气质量日报中涉及的污染物主要是____________和可吸入颗粒物(PM10)。
(2) 汽车尾气则是城市大气中氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,写出反应方程式_______________________________________。
(3) SO2的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
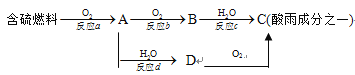
请回答下列问题:
①酸雨的pH____________(填“>”、“<”或“=”)5.6 ;
②反应b的化学方程式为____________________________________;
③在一段时间内连续不断测定溶液D的pH值,发现pH值变小,表示该变化的化学方程式是_________________。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式______________________________________。