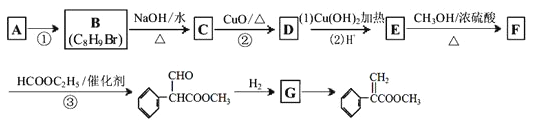
题目内容
【题目】下表是部分城市某日空气质量日报:
城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
SO2 | NO2 | PM10 | |||
A | 98 | 23 | 67 | SO2 | Ⅱ |
B | 47 | 29 | 35 | SO2 | Ⅰ |
C | 62 | 80 | 113 | PM10 | Ⅲ |
D | 52 | 76 | 59 | NO2 | Ⅰ |
(1) 由上表可知,空气质量日报中涉及的污染物主要是____________和可吸入颗粒物(PM10)。
(2) 汽车尾气则是城市大气中氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,写出反应方程式_______________________________________。
(3) SO2的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
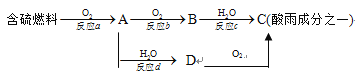
请回答下列问题:
①酸雨的pH____________(填“>”、“<”或“=”)5.6 ;
②反应b的化学方程式为____________________________________;
③在一段时间内连续不断测定溶液D的pH值,发现pH值变小,表示该变化的化学方程式是_________________。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式______________________________________。
【答案】 SO2、NO2 2xCO+2NOx=2xCO2+N2 < 2SO2+O2![]() 2SO3 2H2SO3+O2=2H2SO4 2OH—+SO2=SO3 2—+H2O
2SO3 2H2SO3+O2=2H2SO4 2OH—+SO2=SO3 2—+H2O
【解析】(1)分析图表预报物质和数据可知涉及的污染物主要是二氧化硫、二氧化氮、可吸入颗粒物;故答案为:二氧化硫、二氧化氮;
(2)治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体为氮气和二氧化碳气体,反应的方程式为2xCO+2NOx=2xCO2+N2,故答案为:2xCO+2NOx=2xCO2+N2;
(3) ①酸雨的pH<5.6,故答案为:5.6;
②根据流程图,反应b是二氧化硫的催化氧化,反应的化学方程式为2SO2 + O2 ![]() 2SO3,故答案为:2SO2 + O2
2SO3,故答案为:2SO2 + O2 ![]() 2SO3;
2SO3;
③亚硫酸能够被空气中的氧气氧化生成硫酸,溶液的pH值变小,反应的化学方程式为2H2SO3+O2=2H2SO4,故答案为:2H2SO3+O2=2H2SO4;
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,该反应的化学反应方程式为:SO2+2NaOH=Na2SO3+H2O,离子方程式为2OH—+SO2=SO3 2—+H2O,故答案为:2OH—+SO2=SO3 2—+H2O。

 阅读快车系列答案
阅读快车系列答案