题目内容
【题目】同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
(1) | 2 | 3 | 0 | 27.78kJ |
(2) | 1.6 | 1.8 | 0.8 | Q |
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
【答案】B
【解析】试题分析:A、假如(2)中NH3是反应产生的,则其等效起始状态是2molN2、3molH2、0mol的NH3。二者开始状态相同。所以二者的平衡状态相同,因此平衡时两个容器内压强相等,正确; B、 N2(g)+3H2(g)2NH3(g)△H=-92.6kJ/mol
C(始)mol/L:2 3 0 92.6kJ
C(变)mol/L 1/3 1 2/3 27.78kJ
C(平)mol/L 5/3 2 2/3
K=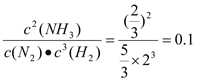
![]() 容器(2)中反应开始时,Qc=
容器(2)中反应开始时,Qc=![]()
所以反应向逆反应方向移动,v(正)<v(逆),错误;C、容器(2)中反应向逆反应方向进行最终达到平衡,所以吸收热量,由于(1)和(2)的平衡常数相同,所以容器(2)中反应达平衡时,吸收的热量Q为1/3×27.78kJ=9.26kJ,正确; D、条件为“绝热恒容”,容器(1)中反应进行中,氨气的物质的量是(27.78kJ÷92.6kJ/mol)×2=0.6mol,由于温度会升高,所以化学平衡会逆向移动,因此反应达平衡时n(NH3)<0.6mol,正确。

练习册系列答案
相关题目