题目内容
下列实验中,不是用对比实验来研究物质化学性质的是
- A.
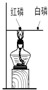
- B.
- C.
- D.
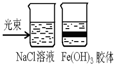
分析:既然是对照实验就应该有一些量是需要一样的,研究同一物质在不同条件下的性质或不同物质在同一条件下的性质,ABC均对照的是研究物质化学性质,而D做的对照实验是溶液与胶体的区别的丁达尔效应,是物理变化,据此即可解答.
解答:A.铜片上的白磷与铜片上的红磷属于对照实验,都与氧气接触,都属于可燃物,变量是着火点不同,白磷着火点低,红磷着火点高,酒精灯加热能达到白磷的着火点,达不到红磷的着火点,从而证明可燃物燃烧温度必须达到可燃物的着火点,所以属于对比实验,故A不选;
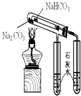
B.对照碳酸氢钠和碳酸钠两种物质的热稳定性,是两种类似的物质在相同条件下发生反应,反应现象是不同的,可以作为对照实验,故B不选;
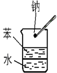
C.是苯和水的与钠反应的对照实验,钠与水反应是化学反应,故C不选;
D.该组实验是对照溶液与胶体的物理性质,胶体具有丁达尔效应,而溶液没有,与题干用对比实验来研究物质化学性质不符,故D选;
故选D.
点评:本题考查的是对照实验与化学变化,解答本题关键是要熟悉反应原理和对比实验的设计思路,题目难度不大.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
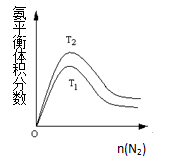
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是:
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: 2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题: