题目内容
某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
| A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
B
解析

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是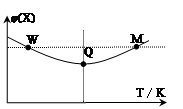
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
| A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1 |
| B.T1℃时反应②的化学平衡常数K=0.6 |
| C.反应①、②均为吸热反应 |
| D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
| A.平衡常数约为0.3 |
| B.B的转化率为60% |
| C.A的平均反应速率为0.3 mol/(L·min) |
| D.若混合气体的密度不变则表明该反应达到平衡状态 |
高温下,某反应达平衡,平衡常数K=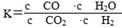 ,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O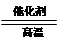 CO2+H2 CO2+H2 |
已知:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤ B.②⑥ C.②③④⑥ D.②④⑥
下列反应中,在高温下不能自发进行的是( )
A.CO(g) C(s)+O2(g) C(s)+O2(g) |
B.NH4Cl(s) NH3(g)↑+HCl(g)↑ NH3(g)↑+HCl(g)↑ |
C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) NH4HCO3(s)+NH3(g) |
D.MgCO3(s) MgO(s)+CO2(g) MgO(s)+CO2(g) |
 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )