题目内容
已知:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤ B.②⑥ C.②③④⑥ D.②④⑥
B
解析

练习册系列答案
相关题目
下列变化不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应 H2(g)+ I2(g) 2HI(g)达平衡, 加压后混合气体颜色变深 2HI(g)达平衡, 加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
有一化学平衡mA(g)+nB(g)  pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )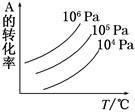
| A.正反应是放热反应;m+n>p+q |
| B.正反应是吸热反应;m+n<p+q |
| C.正反应是放热反应;m+n<p+q |
| D.正反应是吸热反应;m+n>p+q |
某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
| A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
| A.升高温度 | B.加水稀释 |
| C.增大Fe2+的浓度 | D.常温下加压 |
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应
速率最快的是( )
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
在某恒容的密闭容器中,可逆反应A(g)+B(g)  xC(g)有如图所示的关系曲线,下列说法正确的是( )
xC(g)有如图所示的关系曲线,下列说法正确的是( )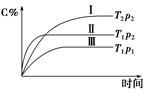
| A.温度:T1>T2 | B.压强:p1>p2 |
| C.正反应是吸热反应 | D.x的值是2 |
 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
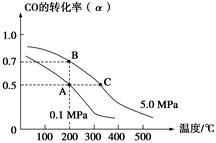
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )