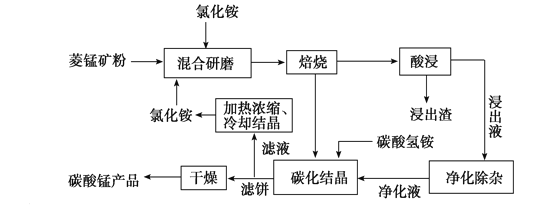
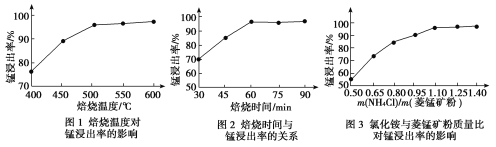
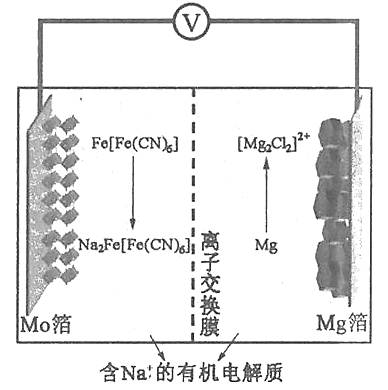
题目内容
【题目】铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___;C、N、O的电负性由大到小的顺序为______。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______;配合物[Cu(NH3)2]OOCCH3中,铜显___价,碳原子的杂化轨道类型是______,NH3价电子对互斥理论模型是______。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________(填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________(写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

【答案】3d64s2 O>N>C [Cu(H2O)4]2+ +1 sp2、sp3杂化 四面体 BD 分子晶体 2∶1 4![]() ∶3
∶3![]()
【解析】
(1)铁是26号元素,根据能量最低原理书写基态Fe原子的核外电子排布式;同周期元素从左到右电负性逐渐增大;
(2)Cu2+在水中与4个H2O分子通过配位键形成配离子;根据化合价代数和等于0计算[Cu(NH3)2]OOCCH3中铜的化合价,[Cu(NH3)2]OOCCH3中有1个单键碳、1个双键碳;NH3中N原子的价电子对数是![]() ;
;
(3)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和σ键生成;
(4) Fe(CO)5常温下为黄色油状液体,说明熔点低;
(5)根据均摊原则计算面心立方晶胞和体心立方晶胞中实际含有的铁原子个数比,根据![]() 计算面心立方堆积与体心立方堆积的两种铁晶体的密度比;
计算面心立方堆积与体心立方堆积的两种铁晶体的密度比;
(1)铁是26号元素,基态Fe原子的核外电子排布式是[Ar] 3d64s2;同周期元素从左到右电负性逐渐增大,C、N、O的电负性由大到小的顺序为O>N>C;
(2)Cu2+在水中与4个H2O分子通过配位键形成配离子,其化学式为[Cu(H2O)4]2+;配合物[Cu(NH3)2]OOCCH3中醋酸根离子(CH3COO-)显-1价,NH3分子整体为0价,根据化合价代数和等于0,可知铜显+1价,[Cu(NH3)2]OOCCH3中有1个C=O和一个甲基,故碳原子的杂化轨道类型是sp2、sp3,NH3中N原子的价电子对数是![]() , NH3价电子对互斥理论模型是四面体。;
, NH3价电子对互斥理论模型是四面体。;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是σ键生成,故选BD;
(4) Fe(CO)5常温下为黄色油状液体,说明其熔点低,故Fe(CO)5属于分子晶体;
(5)根据均摊原则,面心立方晶胞中铁原子数是![]() 、体心立方晶胞中实际含有的铁原子数是
、体心立方晶胞中实际含有的铁原子数是![]() ,个数比是2:1,设铁原子半径是rcm,面心立方晶胞的边长是
,个数比是2:1,设铁原子半径是rcm,面心立方晶胞的边长是![]() 、体心立方晶胞的边长是
、体心立方晶胞的边长是![]() ,根据
,根据![]() ,面心立方堆积与体心立方堆积的两种铁晶体的密度比是
,面心立方堆积与体心立方堆积的两种铁晶体的密度比是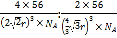 =4
=4![]() ∶3
∶3![]() 。
。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】已知有反应:2A(g)+B(g)![]() 3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项 | x | y |
|
A | 温度 | 容器内混合气体的密度 | |
B | A的物质的量 | B的转化率 | |
C | 催化剂的质量 | C的体积分数 | |
D | 充入稀有气体 | 逆反应速率 |
A. A B. B C. C D. D