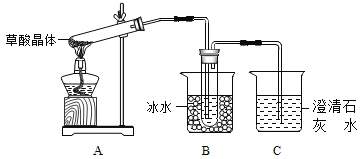
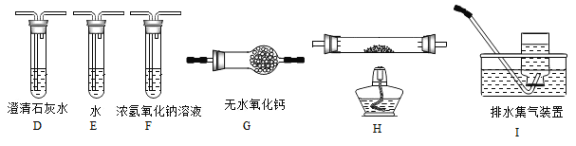
【题目】(14分〕某化学兴趣小组欲探究含硫物质的性质及制备。
【探究一】用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
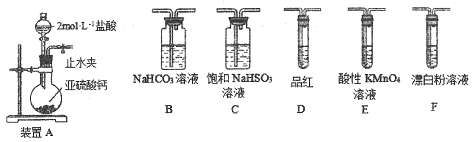
装置连接顺序为_________(用字母表示),其中装置C的作用是___________。
【探究二】
(1)某小组同学为探究SO2的漂白性性质,用下图所示装置进行实验,
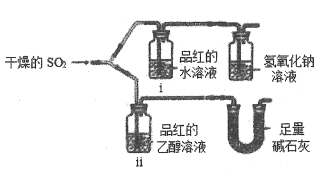
观察到如下现象:i中红色褪去;ii中无变化.碱石灰的作用除了吸收尾气外还有_______的作用。从实验中可知使品红的水溶液褪色的微粒可能是____________。
(2)该小组同学又对SO2与氯水的反应进行探究。
①用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色。②改变氯水用量,重复①操作,发现品红溶液红色褪去,你认为②中品红溶液褪色的原因可能是__________。 设计一个实验(说明操作方法、现象及结论)来验证你的假设________。
【探究三】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制取Na2S2O4常用甲酸钠法。控制温度70-80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液酸性,即可生成Na2S2O4,反应的离子方捏式________。
(2)测定保险粉纯度。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.10mol·L-1的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL.则该样品中Na2S2O4的质量分数为______ (杂质不参与反应)。