题目内容
【题目】科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
(1)鉴别某种金属互化物是晶体还是非晶体的方法是 .
(2)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .
(4)立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b gcm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 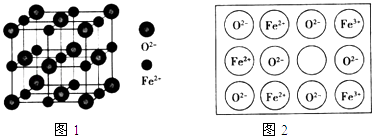
【答案】
(1)X射线衍射
(2)Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO
(3)sp3;5:4;异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键
(4)![]() ?/mol;1:11
?/mol;1:11
【解析】解:(1)晶体、非晶体的方法是X射线衍射,所以答案是:x射线衍射;(2)轨道中电子处于全满、全空、半满时原子最稳定,Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,所以答案是:Cu+的最外层电子排布式为3d10 , 而Cu2+的最外层电子排布为3d9 , 因为最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO;(3)(SCN)2分子中分子结构式为N≡C﹣S﹣S﹣C≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论知硫原子的杂化方式为sp3 , 该分子中σ键和π键数目之比为5:4;含有氢键的物质熔沸点较高,异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键,所以硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,所以答案是:sp3;5:4;异硫氰酸分子间能形成氢键而硫氰酸不能形成氢键;(4)该晶胞中亚铁离子个数=8× ![]() +6×
+6× ![]() =4,氧离子个数=1+12×
=4,氧离子个数=1+12× ![]() =4,
=4,
设晶胞边长为a cm,晶胞体积为a3cm3 , 密度为b gcm﹣3 , 阿伏加德罗常数= ![]() =
= ![]() /mol=
/mol= ![]() /mol;
/mol;
某氧化物样品组成为Fe0.96O,化合物中各元素化合价的代数和为0,根据电荷守恒判断该晶体中Fe3+与Fe2+的离子个数之比,设Fe3+与Fe2+的个数分别是x、y, ![]() ,得
,得![]() ,所以x:y=0.08:0.88=1:11,
,所以x:y=0.08:0.88=1:11,
所以答案是: ![]() /mol;1:11.
/mol;1:11.
【考点精析】关于本题考查的氢键的存在对物质性质的影响,需要了解氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高才能得出正确答案.





