题目内容
【题目】以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是;
(2)D元素的外围电子排布图是 , 在其化合物中,最高正价是;
(3)C元素的原子结构示意图是;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是分子(填极性或非极性),B与L(1:1)的化合物的电子式是;
(5)G、H、L原子的第一电离能由高到低的顺序是(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是;
(7)E元素在元素周期表中的位置是 , 在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是 .
【答案】
(1)As
(2)![]() ;+7
;+7
(3)
(4)极性;![]()
(5)N>O>C
(6)正四面体
(7)第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定
(8)NaH是离子晶体,H2O是分子晶体
(9)H2﹣2e﹣+2OH﹣=2H2O
(10)Al2O3+6HClO4=2Al(ClO4)3+3H2O
【解析】解:(1)由元素在周期表中位置,可知A为氢,B为Na,C为K,D为Mn,E为Fe,F为Al,G为碳,H为N,L为O,J为P,K为As,M为Cl,N为Ar,所以答案是:As;(2)D处于第四周期VIIB族,外围排布式为3d54s2 , 外围电子排布图为 ![]() ,最高正化合价为+7,所以答案是:
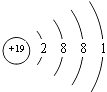
,最高正化合价为+7,所以答案是: ![]() ;+7;(3)C为K元素,原子核外有19个电子,原子结构示意图为:
;+7;(3)C为K元素,原子核外有19个电子,原子结构示意图为:  ,所以答案是:
,所以答案是:  ;(4)A与L形成原子数目1:1的化合物是 H2O2 , 为展开书页型结构,为极性分子,B与L形成原子数目1:1的化合物为Na2O2 , 电子式为
;(4)A与L形成原子数目1:1的化合物是 H2O2 , 为展开书页型结构,为极性分子,B与L形成原子数目1:1的化合物为Na2O2 , 电子式为 ![]() ,所以答案是:极性;
,所以答案是:极性; ![]() ;(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,所以答案是:N>O>C;(6)J单质的一种白色同分异构体为P4 , 为正四面体结构,所以答案是:正四面体;(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定,所以答案是:第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定;(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体,故NaH的熔点更高,所以答案是:NaH是离子晶体,H2O是分子晶体;(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2﹣2e﹣+2OH﹣=2H2O,所以答案是:H2﹣2e﹣+2OH﹣=2H2O;(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水,反应方程式为:Al2O3+6HClO4=2Al(ClO4)3+3H2O,所以答案是:Al2O3+6HClO4=2Al(ClO4)3+3H2O.
;(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,所以答案是:N>O>C;(6)J单质的一种白色同分异构体为P4 , 为正四面体结构,所以答案是:正四面体;(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定,所以答案是:第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定;(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体,故NaH的熔点更高,所以答案是:NaH是离子晶体,H2O是分子晶体;(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2﹣2e﹣+2OH﹣=2H2O,所以答案是:H2﹣2e﹣+2OH﹣=2H2O;(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水,反应方程式为:Al2O3+6HClO4=2Al(ClO4)3+3H2O,所以答案是:Al2O3+6HClO4=2Al(ClO4)3+3H2O.

【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D