题目内容
【题目】一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( ) 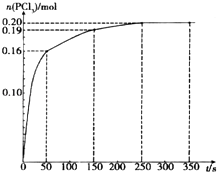
A.反应在50s~250s内的平均速率v(PCl3)=4.0×10﹣4molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 molL﹣1 , 则反应的△H<0
C.保持其他条件不变,将容器的容积缩小一半,平衡逆向移动,化学平衡常数减小
D.相同温度下,起始时向容器中充入0.5 mol PCl5 , 重新达到平衡时,0.1 mol<n(PCl3)<0.2 mol
【答案】D
【解析】解:A.由图中数据可知50s~250s内,△n(PCl3)=0.04mol,v(PCl3)= ![]() =1.0×10﹣4mol/(Ls),故A错误; B.由图中数据可知,平衡时n(PCl3)=0.2mol,则平衡时c(PCl5)=1mol﹣0.2mol=0.8mol,保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol/L,则n′(PCl5)=0.76mol<0.8mol,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即△H>O,故B错误;
=1.0×10﹣4mol/(Ls),故A错误; B.由图中数据可知,平衡时n(PCl3)=0.2mol,则平衡时c(PCl5)=1mol﹣0.2mol=0.8mol,保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol/L,则n′(PCl5)=0.76mol<0.8mol,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即△H>O,故B错误;
C.将容器的容积缩小一半,增大压强,平衡向气体体积减小的方向移动,即平衡向逆反应移动,但平衡常数只受温度影响,压强不影响平衡常数,故C错误;
D.D.与原平衡相比,压强减小,平衡向正反应方向移动,平衡时的PCl5转化率增大,则平衡时PCl3大于0.1mol,而再加入0.5mol PCl5后与原平衡为等效平衡,故0.5 molPCl5转化得到的PCl3小于0.2mol,故D正确,
故选:D.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) . a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
