题目内容
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 . 已知该反应中H2O2只发生如下过程:H2O2﹣→O2 .
(1)该反应中的还原剂是 .
(2)该反应中,发生还原反应的过程是→ .
(3)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目 .
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 .
【答案】
(1)H2O2
(2)H2CrO4;Cr(OH)3
(3)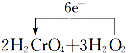 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O
(4)3.36 L
【解析】解:(1)由信息H2O2﹣→O2中可知,O元素的化合价由﹣1价升高到0,则H2O2为还原剂,故答案为:H2O2;(2)氧化剂发生还原反应,含元素化合价降低的物质为氧化剂,则Cr元素的化合价降低,即还原反应的过程为H2CrO4→Cr(OH)3 , 故答案为:H2CrO4;Cr(OH)3;(3)该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6﹣3)=6mol,则用单线桥法标出电子转移的方向和数目为 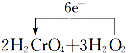 =2Cr(OH)3↓+3O2↑+2H2O,故答案为:
=2Cr(OH)3↓+3O2↑+2H2O,故答案为: 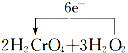 =2Cr(OH)3↓+3O2↑+2H2O;(4)由2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为
=2Cr(OH)3↓+3O2↑+2H2O;(4)由2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为 ![]() mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L. (1)由H2O2只发生如下过程H2O2﹣→O2可知,利用该过程中O元素的化合价由﹣1价升高到0来分析;(2)氧化剂发生还原反应,利用元素的化合价降低来分析;(3)由失去电子的元素指向得到电子的元素,并标出电子转移的总数来用单线桥法标出电子转移的方向和数目;(4)由反应可知生成3mol气体转移6mol电子,以此来计算.
mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L. (1)由H2O2只发生如下过程H2O2﹣→O2可知,利用该过程中O元素的化合价由﹣1价升高到0来分析;(2)氧化剂发生还原反应,利用元素的化合价降低来分析;(3)由失去电子的元素指向得到电子的元素,并标出电子转移的总数来用单线桥法标出电子转移的方向和数目;(4)由反应可知生成3mol气体转移6mol电子,以此来计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案