题目内容
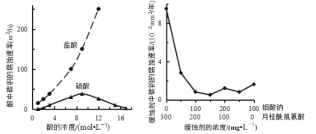
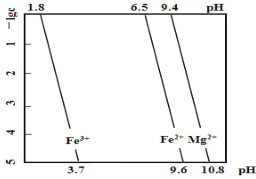
【题目】某工业废渣的主要成分为 SiO2、FeO、MgO,对其进行处理以回收废渣中的金属元素。25℃时,金属离子的物质的量浓度的负对数(-lg c)与溶液pH的关系如图所示(一般离子浓度 c≤10-5mol/L时,即认为该离子在溶液中不存在)。下列有关说法不正确的是
A.分离废渣中的SiO2,可以用过量的盐酸充分反应后过滤
B.可以用氯水将Fe2+氧化成Fe3+以便于铁元素与镁元素的分离
C.沉淀金属元素的顺序是先沉淀镁元素再沉淀铁元素
D.用 NaOH 调节pH沉淀铁元素时,pH应控制略大于3.7
【答案】C
【解析】
A.回收废渣中的金属元素,可加盐酸分离出SiO2;
B.结合图中pH可知,铁离子在pH为3.7附近沉淀完全;
C.先沉淀铁离子,过滤后再沉淀镁子,可分离;
D.铁离子在pH为3.7附近沉淀完全,此时镁以离子存在。
A.回收废渣中的金属元素,SiO2与盐酸不反应,MgO、FeO均溶于盐酸,则分离废渣中的 SiO2,可以用过量的盐酸充分反应后过滤,A正确;
B.结合图中pH可知,Fe3+在pH为3.7附近沉淀完全,则用氯水将 Fe2+氧化成 Fe3+以便于铁元素与镁元素的分离,B正确;
C.Fe3+、Mg2+形成沉淀需要溶液的pH:Fe3+<Mg2+,所以先沉淀Fe3+形成Fe(OH)3沉淀,过滤后再沉淀Mg2+,使Mg2+形成Mg(OH)2沉淀,而可分离,离子沉淀的顺序不合理,C错误;
D.Fe3+在pH为3.7附近沉淀完全,此时镁以Mg2+存在于溶液中在,则用NaOH调节pH沉淀铁元素时,pH应控制略大于3.7,D正确;
故合理选项是C。

练习册系列答案
相关题目