题目内容
(10分)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:
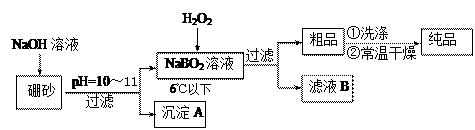
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+)=0.056 mol?L-1,那么需调节溶液的pH= ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)="1:" 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)

(4)若反应温度控制不当,所得的过硼酸钠晶 体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
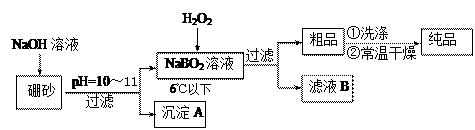
(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为 ▲ ;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁。若加碱前溶液中c(Mg2+)=0.056 mol?L-1,那么需调节溶液的pH= ▲ 时,才开始出现沉淀。[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B): n(H) :n(O)="1:" 1: n: 7。将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如图所示,则T3时所得晶体的化学式为___▲___。(书写简单计算过程)

(4)若反应温度控制不当,所得的过硼酸钠晶
 体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。
体中将混有NaBO2 ,则产品中钠的质量分数 ▲ (填 “升高”、“降低”或“不变”)。(每空2分,共10分)(1)B4O 72- + 2OH- = 4BO2- + H2O (2分)
72- + 2OH- = 4BO2- + H2O (2分)
(2)pH =9 (2分)
(3)NaBO3·H2O (化学式2分,过程2分,共4分)
计算过程:T3时,nNa=(20.0g×23%)/23g.mol-1="0.2mol " (1分)
则30.8g样品中,nNa:nB:nH:nO=0.2:0.2:0.2n:1.4
有:0.2×23+0.2×11+0.2n+1.4×16=30.8
解出n="8 " 则原晶体为:NaBO3·4H2O (1分)
进一步根据T3时所得晶体中钠元素的质量分数,求出结晶水数目为1 。
所以T3时所得晶体的化学式为NaBO3·H2O (2分)
(4)升高 (2分)
 72- + 2OH- = 4BO2- + H2O (2分)
72- + 2OH- = 4BO2- + H2O (2分)(2)pH =9 (2分)
(3)NaBO3·H2O (化学式2分,过程2分,共4分)
计算过程:T3时,nNa=(20.0g×23%)/23g.mol-1="0.2mol " (1分)
则30.8g样品中,nNa:nB:nH:nO=0.2:0.2:0.2n:1.4
有:0.2×23+0.2×11+0.2n+1.4×16=30.8
解出n="8 " 则原晶体为:NaBO3·4H2O (1分)
进一步根据T3时所得晶体中钠元素的质量分数,求出结晶水数目为1 。
所以T3时所得晶体的化学式为NaBO3·H2O (2分)
(4)升高 (2分)
略

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
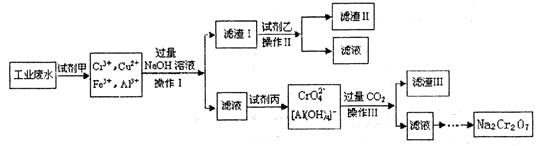
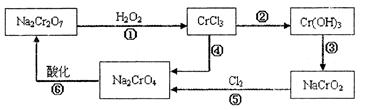
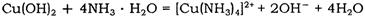
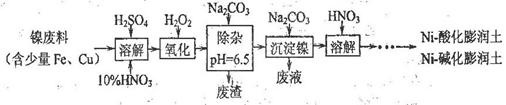
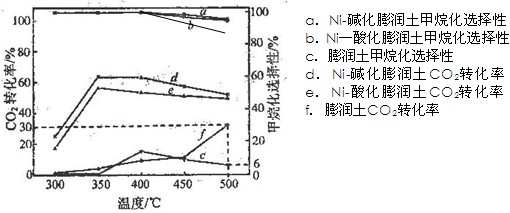
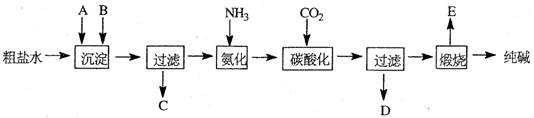
 元素的质量分数为26.7%,其余为N、S。
元素的质量分数为26.7%,其余为N、S。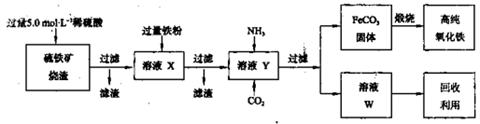
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。