题目内容
19.下列分子构型呈正四面体结构的是①③⑤.①P4 ②NH3 ③CCl4 ④金刚石 ⑤CH4 ⑥SiO2 ⑦H2O ⑧CO2.
分析 分子或离子的结构可以根据价层电子对互斥理论确定,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,;常见的单质可以根据其结构图分析.
①P4分子构型为正四面体;
②NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对;
③CCl4分子中碳原子sp3杂化,没有弧对电子对;
④金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化,构型为正四面体,但无分子存在;
⑤CH4分子中碳原子sp3杂化,没有弧对电子对;
⑥SiO2是空间网状结构,一个Si原子周围连有4个O原子,Si原子原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子,而杂化轨道用于形成σ键和容纳孤对电子,故SiO2中Si的杂化类型是sp3杂化,构型为正四面体,但无分子存在;
⑦H2O分子中氧原子sp3杂化,有两对弧对电子对;
⑧CO2分子中碳原子sp杂化.
解答 解:①P4 为分子晶体,其分子结构为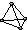 ,为正四面体结构,故①正确;
,为正四面体结构,故①正确;
②氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,
故②错误;
③CCl4中中心原子价层电子对个数为4,为四面体结构,4个共价键完全相同,是正四面体,故③正确;
④金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,碳原子采取sp3杂化,构型为正四面体结构,金刚石的结构为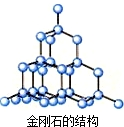 ,但是金刚石为原子晶体,不存在分子,故④错误;
,但是金刚石为原子晶体,不存在分子,故④错误;
⑤CH4中中心原子价层电子对个数为4,4个共价键完全相同,碳原子采用sp3杂化,则其分子结构为四面体结构,故⑤正确;
⑥SiO2晶体结构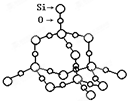 ,二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角,但是二氧化硅晶体为原子晶体,不存在分子,故⑥错误;
,二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角,但是二氧化硅晶体为原子晶体,不存在分子,故⑥错误;
⑦H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以O原子采用sp3杂化,有两对弧对电子对,所以分子构型为V型,故⑦错误;
⑧CO2分子碳原子的价层电子对是2,一个CO2分子中含有2个π键,C原子杂化轨道数=σ键数+孤对电子对数=2+0=2,所以碳原子采用SP杂化,所以分子构型为直线型,故⑧错误;
故答案为:①③⑤.
点评 本题考查了分子的空间构型的判断,注意把握价层电子对互斥理论的应用,明确晶体结构是解此题关键,注意理解熟记常见分子的空间构型,题目难度中等.

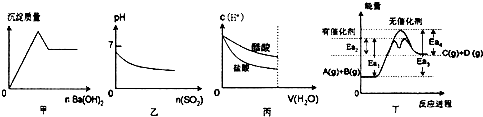
| A. | 甲是向KAl(S04)2溶液滴加Ba(OH)2时,沉淀质量与Ba(OH)2物质的量的关系图 | |
| B. | 乙是向溴水通入SO2气体时,pH与SO2物质的量的关系图 | |
| C. | 丙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 | |
| D. | 由丁可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H=+(Ea3-Ea4)kJ/mol |
| A. | 生石灰用作食品抗氧剂 | B. | 氢氧化镁做胃酸中和剂 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 明矾做天然水消毒剂 |
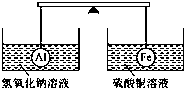
| A. | 两烧杯中均无气泡产生 | B. | 左边烧杯中的溶液质量减少了 | ||
| C. | 去掉两烧杯,杠杆仍平衡 | D. | 右边铁球上出现红色 |
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2$\stackrel{高温}{→}$2PbO+2SO2;
③制粗铅:PbO+C$\stackrel{高温}{→}$Pb+CO↑;PbO+CO$\stackrel{高温}{→}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 | |
| D. | 将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
| A. | 蛋白质溶液、淀粉溶液都属胶体 | |
| B. | 碳纤维、纤维素都是有机高分子 | |
| C. | 花生油,牛油互为同分异构体 | |
| D. | 普通玻璃、石英玻璃、水玻璃都是硅酸盐 |
| A. | Na久置于空气中,最终生成NaHCO3 | |
| B. | 在高温下用氢气还原AlCl3可制取金属铝 | |
| C. | SiO2与焦炭反应,再经化学提纯得高纯硅 | |
| D. | N2在放电条件下与O2反应生成NO2 |
| A. | X与Y形成的化合物只有一种 | |
| B. | R的氢化物的热稳定性比W的强 | |
| C. | 原子半径:r(Z)<r(R) | |
| D. | Y的最高价氧化物的水化物的酸性比W的强 |