题目内容
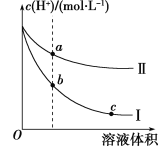
【题目】甲装置中所含的是物质的量之比为1∶2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
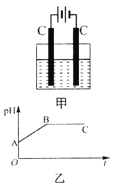
A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.BC段阴极产物和阳极产物的体积之比为2∶1
C.AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
【答案】B
【解析】
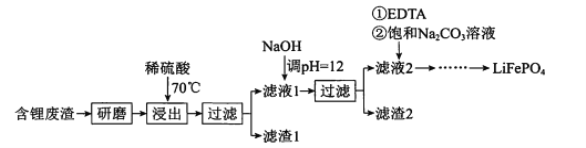
假设溶液中n(CuSO4)=1mol、n(NaCl)=2mol,电解初始,阳极上氯离子放电、阴极上铜离子放电,当转移2mol电子时,阴极上铜离子完全放电生成Cu、阳极上氯离子完全放电生成氯气,溶液中的溶质之间变为硫酸钠,当铜离子、氯离子完全放电后,继续电解,实际上是电解水,溶液的pH不变,据以上分析解答。
假设溶液中n(CuSO4)=1mol、n(NaCl)=2mol,电解初始,阳极上氯离子放电、阴极上铜离子放电,当转移2mol电子时,阴极上铜离子完全放电生成Cu、阳极上氯离子完全放电生成氯气,溶液中的溶质之间变为硫酸钠,当铜离子、氯离子完全放电后,继续电解,实际上是电解水,溶液的pH不变,
A.硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,B点铜离子和氯离子完全放电,溶液中的溶质为强酸强碱盐硫酸钠,所以A点pH小于B点,A项错误;
B.BC段是电解水,阴极上生成氢气、阳极上生成氧气,所以阴极产物和阳极产物的体积之比为2:1,B项正确;
C.AB段是电解CuCl2、BC段是电解H2O,AB段阴极电极反应式为Cu2++2e-=Cu、BC段阴极电极反应式为2H++2e-=H2↑,C项错误;
D.整个电解过程中溶液不呈碱性,所以不会出现氢氧化铜蓝色沉淀,D项错误;
答案选B。

 能力评价系列答案
能力评价系列答案【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
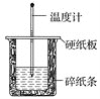
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________
【题目】已知几种盐溶液的pH如表所示:
① | ② | ③ | |
均为0.1 mol·L-1溶液 | NaHCO3 | Na2CO3 | NaClO |
常温下溶液pH | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.三种溶液中水的电离程度:①>③>②
B.每种溶液都只存在1种微粒的电离平衡
C.①与②中均存在:c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)
D.向NaClO溶液中通入少量CO2的反应为ClO-+CO2+H2O=HClO+HCO3-
【题目】二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1= ________(用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp 的计算式为:![]() (Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向_______ (填“增大”、“不变”或“减小”)。
②某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
③200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为 _______(填标号)。
A.<![]() B.
B.![]() C.
C.![]() ~
~![]() D.
D.![]() E.>
E.>![]()
④300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律__________________________,原因_______________________。

(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①该电池的负极反应式为:_______________。
②某直接二甲醚燃料电池装置的能量利用率为 50%,现利用该燃料电池电解氯化铜溶液,若消耗 2.3g 二甲醚,得到铜的质量为_______ g。