题目内容
【题目】二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1= ________(用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp 的计算式为:![]() (Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向_______ (填“增大”、“不变”或“减小”)。
②某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
③200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为 _______(填标号)。
A.<![]() B.
B.![]() C.
C.![]() ~
~![]() D.
D.![]() E.>
E.>![]()
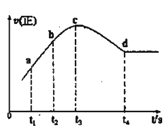
④300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律__________________________,原因_______________________。

(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①该电池的负极反应式为:_______________。
②某直接二甲醚燃料电池装置的能量利用率为 50%,现利用该燃料电池电解氯化铜溶液,若消耗 2.3g 二甲醚,得到铜的质量为_______ g。
【答案】ΔH4-2ΔH2- ΔH3 减小 > C 规律:压强增大,甲醇转化率减小 原因:压强增大,催化剂吸附水分子的量增多,催化效率降低 CH3OCH3 -12e-+3H2O=2CO2+12H+ 9.6g
【解析】
(1)结合已知热化学反应方程式,根据盖斯定律解答;
(2)①根据温度对2CH3OH(g)![]() CH3OCH3(g) + H2O(g)反应的平衡移动的影响分析;
CH3OCH3(g) + H2O(g)反应的平衡移动的影响分析;
②结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g),根据表格数据,比较Qp与Kp的大小,确定反应进行方向,进而判断正、逆反应速率的大小;
CH3OCH3(g) + H2O(g),根据表格数据,比较Qp与Kp的大小,确定反应进行方向,进而判断正、逆反应速率的大小;
③200℃时,根据![]() (Kp 为以分压表示的平衡常数,T为热力学温度)计算平衡时Kp,结合反应2CH3OH(g)
(Kp 为以分压表示的平衡常数,T为热力学温度)计算平衡时Kp,结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)判断达平衡状态时体系中CH3OCH3(g)的物质的量分数;
CH3OCH3(g) + H2O(g)判断达平衡状态时体系中CH3OCH3(g)的物质的量分数;
④300℃时,根据图1中曲线随压强的变化分析变化规律;
(3)①该电池为燃料电池,燃料电池中一般燃料做负极,燃料燃烧生成二氧化碳和水,据此书写负极反应式;
②计算2.3g 二甲醚完全燃烧时转移电子的物质的量,再根据电子守恒计算生成铜的质量。
(1)已知:①2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
②CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
③3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
由盖斯定律可知,③-①×2-②得2CH3OH(g)![]() CH3OCH3(g) + H2O(g)ΔH1=ΔH4-2ΔH2- ΔH3;
CH3OCH3(g) + H2O(g)ΔH1=ΔH4-2ΔH2- ΔH3;
(2)①![]() ,则Kp=
,则Kp=![]() ,温度越高,
,温度越高,![]() 越小,
越小,![]() 越小,即Kp越小,反应向逆向进行倾向增大,则CH3OH(g)脱水转化为二甲醚的倾向减小;
越小,即Kp越小,反应向逆向进行倾向增大,则CH3OH(g)脱水转化为二甲醚的倾向减小;
②结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)可知Qp=
CH3OCH3(g) + H2O(g)可知Qp=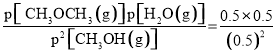 =1<Kp=100,则反应正向进行,则v正 >v逆;
=1<Kp=100,则反应正向进行,则v正 >v逆;
③200℃时,根据:![]() =
=![]() 3.52,则Kp>1。若反应初始投入CH3OH(g)1mol,完全反应全部转化为CH3OCH3(g)和H2O(g),根据反应比例关系,CH3OCH3(g)和H2O(g)各占一半,即CH3OCH3(g)的物质的量分数为
3.52,则Kp>1。若反应初始投入CH3OH(g)1mol,完全反应全部转化为CH3OCH3(g)和H2O(g),根据反应比例关系,CH3OCH3(g)和H2O(g)各占一半,即CH3OCH3(g)的物质的量分数为![]() ,由于反应为可逆反应,不可能完全转化,反应平衡时,CH3OCH3(g)的物质的量分数小于
,由于反应为可逆反应,不可能完全转化,反应平衡时,CH3OCH3(g)的物质的量分数小于![]() ;如果平衡时三种物质的含量相同,即均为1/3,由于反应前后体积不变,则此时Kp=1,因此要使Kp>1,则CH3OCH3(g)的物质的量分数一定大于
;如果平衡时三种物质的含量相同,即均为1/3,由于反应前后体积不变,则此时Kp=1,因此要使Kp>1,则CH3OCH3(g)的物质的量分数一定大于![]() 。答案选C;
。答案选C;
④300℃时,根据图1中曲线随压强的变化规律:当压强越大,甲醇转化率减小;根据反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g),反应前后气体体积不变,平衡不随压强的变化发生移动,出现该图曲线变化的原因是:压强增大,催化剂吸附水分子的量增多,催化效率降低;
CH3OCH3(g) + H2O(g),反应前后气体体积不变,平衡不随压强的变化发生移动,出现该图曲线变化的原因是:压强增大,催化剂吸附水分子的量增多,催化效率降低;
(3)①该电池为燃料电池,燃料电池中一般燃料做负极,负极发生氧化反应,燃料燃烧生成二氧化碳和水,结合装置如图 2,负极反应式:CH3OCH3 -12e-+3H2O=2CO2+12H+;
②负极反应式为CH3OCH3 -12e-+3H2O=2CO2+12H+,2.3g 二甲醚物质的量为![]() =0.05mol,二甲醚燃料电池装置的能量利用率为50%时,转移电子的物质的量=0.05mol×12×50%=0.3mol,根据Cu2++2e-=Cu,则生成铜的物质的量=
=0.05mol,二甲醚燃料电池装置的能量利用率为50%时,转移电子的物质的量=0.05mol×12×50%=0.3mol,根据Cu2++2e-=Cu,则生成铜的物质的量=![]() ×0.3mol=0.15mol,质量为0.15mol×64g/mol=9.6g。
×0.3mol=0.15mol,质量为0.15mol×64g/mol=9.6g。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。