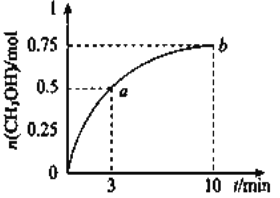
题目内容
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中![]() 的空间构型为________,写出与
的空间构型为________,写出与![]() 互为等电子体的一种非极性分子化学式__________________________________________________________________。
互为等电子体的一种非极性分子化学式__________________________________________________________________。
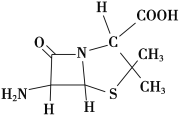
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(CH2CH2)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
化学键 | Si—Si | O===O | Si—O |
键能(kJ·mol-1) | a | b | c |
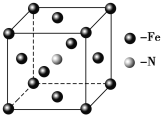
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。
 .
.
【答案】3d64s2 平面正三角形 BF3(SO3、BBr3等) C、N、O、S a 8Fe+2NH3![]() 2Fe4N+3H2
2Fe4N+3H2
【解析】
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)根据价层电子对互斥理论确定离子空间构型,原子个数相等价电子数相等的微粒是等电子体,正负电荷重心重合的分子是非极性分子;
(3)根据价层电子对互斥理论确定碳原子杂化方式;
(4)a.氢键的存在影响物质的熔沸点;
b.根据化合物中化合价的代数和为0计算;
c.聚乙烯(![]() )分子中有(6n-1)个σ键;
)分子中有(6n-1)个σ键;
d.60gSiO2的物质的量=![]() mol=1mol,一个硅原子含有4个硅氧键;
mol=1mol,一个硅原子含有4个硅氧键;
(5)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式。
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2;
(2)NO3-中N原子价层电子对=3+![]() (5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构;与NO3-互为等电子体的一种非极性分子有BF3(SO3、BBr3等);
(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构;与NO3-互为等电子体的一种非极性分子有BF3(SO3、BBr3等);
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S;
(4)a.乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,故a正确;
b.根据化合物中化合价的代数和为0知,钨的配合物离子[W(CO)5OH]-中钨显0价,故b错误;
c.聚乙烯(![]() )分子中有(6n-1)个σ键,故c错误;
)分子中有(6n-1)个σ键,故c错误;
d.由表中数据知反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能量为(4c-2a-b)kJ,故d错误;
故答案为a;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3![]() 2Fe4N+3H2。
2Fe4N+3H2。

 阅读快车系列答案
阅读快车系列答案