题目内容
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是工业上从铝土矿(主要成分是Al2O3,含有少量SiO2、Fe2O3等杂质)中生产铝的工艺流程:
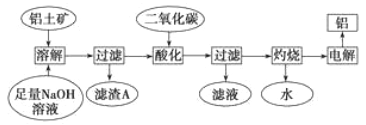
据此回答下列问题:
(1)电解制取铝的化学反应中,反应物的键能之和_____生成物的键能之和(填“大于”、“小于”或“等于”)。
(2)铝土矿中绝大部分成分都可以溶解在NaOH溶液中。请根据周期表对角线规则写出铍的氧化物与NaOH溶液反应的离子方程式:______________。
(3)滤渣A的主要成分____________。
(4)在工艺流程第三步中,通入过量二氧化碳所发生反应的化学方程式_______________。
(5)某同学在实验室模拟工业生产铝,称取ag铝土矿可制得bgAl(儇设每步反应进行完全),则铝土矿中Al2O3的质量分数为____________。
【答案】 大于 BeO+2OH-= BeO22-+ H2O Fe2O3 NaAlO2+CO2+2H2O= AlOH)3↓+ NaHCO3 ![]()
【解析】本题考查化学工艺流程,(1)电解氧化铝,此反应类型属于分解反应,属于吸热反应,即反应物的键能总和大于生成物的键能总和;(2)Be与铝元素处于对角线,氧化铝与氢氧化钠反应生成偏铝酸钠和水,即BeO+2OH-=BeO22-+H2O;(3)氧化铁是碱性氧化物,不与NaOH溶液反应,氧化铝是两性氧化物,SiO2是酸性氧化物,都与NaOH溶液反应,因此滤渣为Fe2O3;(4)第二步过滤,得到滤液中含有SiO32-和AlO2-,又因为碳酸的酸性强于硅酸和偏铝酸,因此发生的反应是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)题目中,每步反应进行完全,因此根据铝元素守恒,即n(Al2O3)=b/54mol,因此m(Al2O3)=102b/54mol=17b/9mol,其质量分数为![]() 。
。