题目内容
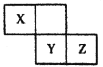
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是______,碱性最强的化合物的化学式是_______。
(2)⑤⑦形成化合物的电子式___。②形成的最高价氧化物的结构式____。
(3)最高价氧化物是两性氧化物的元素其元素符号是____;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式________。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________。
【答案】 高氯酸 NaOH ![]()
![]() O=C=O Al Al(OH)3+3H+=Al3++3H2O 2Al+2H2O+2OH-=2AlO2-+3H2↑
O=C=O Al Al(OH)3+3H+=Al3++3H2O 2Al+2H2O+2OH-=2AlO2-+3H2↑ ![]()
【解析】考查元素周期表和元素周期律的应用,(1)同周期从左向右非金属性增强,同主族从上到下非金属性减弱,但中学阶段O和F没有正价,即最高价氧化物的水化物酸性最强的是Cl,其最高价氧化物对应水化物是HClO4,名称为高氯酸;同周期从左向右金属性减弱,同主族从上到下金属性增强,即钠元素的金属性最强,其最高价氧化物的水化物是NaOH;(2)⑤⑦形成化合物是Na2O和Na2O2,电子式分别是:![]() 、
、![]() ;②为碳原子,其最高价氧化物是CO2,结构式为O=C=O;(3)表现两性的氧化物是Al;Al的氢氧化物是Al(OH)3,氢氧化铝表现两性,⑧的最高价氧化物的水化物是HClO4,两者反应离子方程式为Al(OH)3+3H+=Al3++3H2O;(4)⑥的单质是Al,⑤的最高价氧化物对应的水化物是NaOH,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)②和⑦按1:2形成的液态化合物是CS2,用电子式表示CS2形成的过程:
;②为碳原子,其最高价氧化物是CO2,结构式为O=C=O;(3)表现两性的氧化物是Al;Al的氢氧化物是Al(OH)3,氢氧化铝表现两性,⑧的最高价氧化物的水化物是HClO4,两者反应离子方程式为Al(OH)3+3H+=Al3++3H2O;(4)⑥的单质是Al,⑤的最高价氧化物对应的水化物是NaOH,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)②和⑦按1:2形成的液态化合物是CS2,用电子式表示CS2形成的过程:![]() 。
。