题目内容
【题目】![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的二种酸HX、
的二种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如下表,下列判断正确的是
,实验数据如下表,下列判断正确的是![]()
数据编号 | NaOH加入的体积 | 溶液的pH | |
|
| ||
① | 0 | 3 | 1 |
② | a | 7 | |
③ |
| x | y |
A.在相同温度下,同浓度的两种酸溶液的导电能力顺序![]()
B.由表中数据可估算出![]()
C.HY和HX混合,![]()
D.上述②反应后的HY溶液中:![]()
【答案】A
【解析】
A.根据表中数据分析,![]() 的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸,同浓度的两种酸溶液的导电能力顺序
的酸HX、HY的pH分别为3、1,可知HX为弱酸、HY为强酸,同浓度的两种酸溶液的导电能力顺序![]() ;
;
B.HY为强酸,不存在电离平衡常数;
C.根据混合液中的物料守恒和电荷守恒分析;
D.HY为强酸,与氢氧化钠反应时HY酸过量,溶液显酸性,![]() 。
。
A.由①知,![]() 的HY溶液的
的HY溶液的![]() ,说明HY是强酸;而
,说明HY是强酸;而![]() 的HX溶液的
的HX溶液的![]() ,说明HX是弱酸,所以在相同温度下,同浓度的两种酸溶液的导电能力顺序
,说明HX是弱酸,所以在相同温度下,同浓度的两种酸溶液的导电能力顺序![]() ,故A正确;
,故A正确;
B.根据分析可知,HY为强酸,则不存在电离平衡常数,故B错误;
C.将![]() 的HX和HY混合,当达平衡时,根据物料守恒得①
的HX和HY混合,当达平衡时,根据物料守恒得①![]() ,将①代入到电荷守恒
,将①代入到电荷守恒![]() 中可得:
中可得:![]() ,故C错误;
,故C错误;
D.上述②反应后的HX溶液显中性,因为HX为弱酸,则![]() mL,由于HY为强酸,故HY酸过量,
mL,由于HY为强酸,故HY酸过量,![]() ,结合电荷守恒可知:
,结合电荷守恒可知:![]() ,溶液中正确的离子浓度大小为:
,溶液中正确的离子浓度大小为:![]() ,故D错误;
,故D错误;
故答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
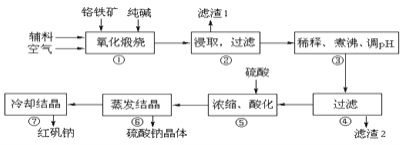
①中涉及的主要反应有:
主反应:![]()
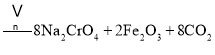
副反应: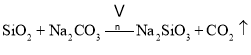 、
、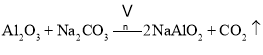
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .