题目内容
15.硫、硫化物和硫酸盐在自然界都存在.(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:
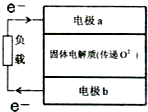
①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),加入稀硫酸溶解过滤得到溶液中主要是硫酸铁、硫酸铝、硫酸亚铁、硫酸镁、硫酸钙,加入铁粉还原铁离子为亚铁离子,加入氧化钙调节溶液PH使铝离子全部沉淀,冷却结晶,过滤洗涤得到得到粗制硫酸亚铁晶体,加入水溶解后加入硫酸调节溶液PH,抑制硫酸亚铁水解,蒸发浓缩,冷却结晶,过滤洗涤得到精制硫酸亚铁晶体,
①上述流程中加入铁屑时反应是铁和过量硫酸、溶液中硫酸铁发生反应;
②制备过程中加入CaO调节pH=4.5时,依据图表中离子沉淀的PH,使铝离子全部沉淀;
③硫酸亚铁溶液中亚铁离大于70℃时,子水解,向滤液中加入H2SO4调节pH抑制亚铁离子的水解;
④大于70℃时,亚铁离子被氧化为铁离子;
(3)根据总反应2H2S+O2═2S↓+2H2O分析,得到硫化氢在负极失电子发生氧化反应生成硫单质,氧气在正极得电子发生还原反应生成氧离子,据此分析.
解答 解:(1)①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
②2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-196.6kJ•mol-1
③SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ•mol-1
依据盖斯定律①+②×4+③×8,得到反应热化学方程式为:4FeS2(s)+15O2(g)+8H2O(l)=2Fe2O3(s)+8H2SO4(l)的△H=-3412-196.6×4-130.3×8=-5240.8KJ/mol,所以生产2mol H2SO4(l)所释放出的热量为$\frac{5240.8}{4}$=1310.2KJ;故答案为:1310.2;
(2)硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),加入稀硫酸溶解过滤得到溶液中主要是硫酸铁、硫酸铝、硫酸亚铁、硫酸镁、硫酸钙,加入铁粉还原铁离子为亚铁离子,加入氧化钙调节溶液PH使铝离子全部沉淀,冷却结晶,过滤洗涤得到得到粗制硫酸亚铁晶体,加入水溶解后加入硫酸调节溶液PH,抑制硫酸亚铁水解,蒸发浓缩,冷却结晶,过滤洗涤得到精制硫酸亚铁晶体,
①上述流程中加入铁屑时反应是铁和过量硫酸、溶液中硫酸铁发生反应,反应的离子方程式为:Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+;
②制备过程中加入CaO调节pH=4.5时,依据图表中离子沉淀的PH,使铝离子全部沉淀,产生沉淀的主要成分为Al(OH)3,
故答案为:Al(OH)3;
③硫酸亚铁溶液中亚铁离大于70℃时,子水解,向滤液中加入H2SO4调节pH抑制亚铁离子的水解,精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解,
故答案为:抑制Fe2+离子的水解;
④结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因是大于70℃时,亚铁离子被氧化为铁离子,硫酸亚铁纯度降低的主要原因可能为;可能是亚铁离子被氧化为铁离子的量增多,
故答案为:可能是亚铁离子被氧化为铁离子的量增多;
(3)①根据总反应2H2S+O2═2S↓+2H2O分析,得到硫化氢在负极失电子发生氧化反应生成硫单质,氧气在正极得电子发生还原反应生成氧离子,又电子从b流向a极即b为负极,a为正极,故答案为:b;
②b为负极,硫化氢失电子发生氧化反应生成硫单质,反应式为:H2S-2e-+O2-=S↓+H2O,故答案为:H2S-2e-+O2-=S↓+H2O.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,混合物的分离的实验流程分析,原电池原理、离子性质和除杂的条件选择是解题关键,掌握基础是解题关键,题目难度中等.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | “白毛”的主要咸分是氧化铝 | |
| B. | 在长出“白毛”过程中,铝片的温度会升高 | |
| C. | 若用硝酸汞溶液代替汞就无法看到类似的现象 | |
| D. | 此过程中涉及到的化学变化与原电池的原理有关 |
| A. | 稳定性:H2S>HF | B. | HCl的电子式为 | ||
| C. | H2O的摩尔质量为18 | D. | 在卤化氢中HI最稳定 |

 .
.


 .
.