题目内容
14.将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴有汞的地方会较快地长出“白毛”.关于该实验说法错误的是( )| A. | “白毛”的主要咸分是氧化铝 | |
| B. | 在长出“白毛”过程中,铝片的温度会升高 | |
| C. | 若用硝酸汞溶液代替汞就无法看到类似的现象 | |
| D. | 此过程中涉及到的化学变化与原电池的原理有关 |
分析 A.铝化学性质比较活泼,而汞化学性质不活泼,所以生成的白毛为氧化铝;
B.绝大多数化合反应是放热反应,铝与氧气反应放出热量;
C.若用硝酸汞溶液代替汞,铝能置换出硝酸汞中的汞,能看到类似的现象;
D.将一滴汞滴在已除去表面氧化膜的铝片上,有原电池的两极,但缺电解质.
解答 解:将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴有汞的地方会较快地长出“白毛”,这是因为铝汞齐的存在,这时的氧化铝不再是致密结构,生成疏松的白色氧化铝成毛刷状.
A.铝化学性质比较活泼,易与氧气生成氧化铝,而汞化学性质不活泼,所以生成的白毛为氧化铝,化学式为Al2O3,故A正确;
B.绝大多数化合反应是放热反应,铝在空气中易与氧气生成氧化铝,属于化合反应,“白毛”的主要咸分是氧化铝,在长出“白毛”过程中,铝片的温度会升高,故B正确;
C.铝活泼性大于汞,铝与硝酸汞溶液发生了置换反应,反应的化学方程式为:2Al+3Hg(NO3)2=2Al(NO3)3+3Hg,铝与氧气的反应能继续进行,由于汞齐的存在,这时的氧化铝不再是致密结构,所以生成疏松的白色氧化铝成毛刷状,能看到滴有汞的地方会较快地长出“白毛”的现象,故C错误;
D.构成原电池需电解质,将一滴汞滴在已除去表面氧化膜的铝片上,只有铝、汞两种金属,长出“白毛”是铝与氧气发生化学反应生成氧化铝,故D错误;
故选CD.
点评 本题考查了铝的化学性质应用,此题是结合实验对铝与汞性质的考查,解题的关键是掌握性质与现象的关系,题目难度中等.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
4.被誉为“光纤之父”的华人科学家高锟获2009年诺贝尔物理学奖.关于光导纤维的说法,错误的是( )
| A. | 光导纤维的主要成分是氧化物 | |
| B. | 由石英玻璃拉制成细丝的过程是化学变化 | |
| C. | 光导纤维是利用激光传输信息的 | |
| D. | 光纤通信不容易受外界干扰,能够传播得更远 |
5.下列溶液中溶质物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解在1L水中 | |
| B. | 将22.4L HCl气体溶于水配成1L溶液 | |
| C. | 将0.1L 10 mol•L-1浓硫酸加入0.9L水中 | |
| D. | 将25g 胆矾溶于水配成100mLCuSO4溶液 |
6.下列物质属于酚类的是( )
| A. |  | B. | 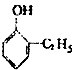 | C. |  | D. | 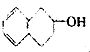 |
15.硫、硫化物和硫酸盐在自然界都存在.
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
回答下列问题:
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:

①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:

①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.