题目内容
13.(1)①某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.②在25℃时,将cmol•L-1的醋酸溶液与0.02mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的Ka=$\frac{2×1{0}^{-9}}{c-0.02}$mol•L-1.
(2)与水的离子积Kw=C(H+)•C(OH-)相似,CuS饱和溶液中也有离了积KSP=C(Cu2+)•C(S2-).
已知t℃时CuS的离子积KSP=9.0×10-36,又已知t℃时H2S饱和溶液中C(H+)2•C(S2-)=1.0×10-22
①写出CuS沉淀溶解平衡的表达式CuS2(s)?Cu2+(aq)+2S2-(aq)
②现将适量CuS放入H2S饱和溶液中,要使C(Cu2+)达到0.01mol•L-1时,应使该溶液的C(H+)达到3.33×105mol/L.由此说明CuS在一般酸中不能溶解.(填“能”或“不能”)
分析 (1)①0.01mol/L NaOH溶液,c(OH-)=0.01mol/L,pH=11,则c(H+)=10-11mol/L,Kw=c(OH-)×c(H+)=10-13;将pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.1mol/L,反应后混合溶液为中性,则Va L×0.01mol/L=Vb L×0.1mol/L;
②根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),根据溶液的pH值计算溶液中c(H+),根据钠离子浓度计算c(CH3COO-),利用物料守恒计算溶液中c(CH3COOH),溶液中存在平衡CH3COOH?CH3COO-+H+,代入CH3COOH的电离常数表达式计算;
(2)①CuS沉淀溶解产生Cu2+和S2-;
②根据硫化亚铜的溶度积常数和铜离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度.
解答 解:(1)0.01mol/L NaOH溶液,c(OH-)=0.01mol/L,pH=11,则c(H+)=10-11mol/L,Kw=c(OH-)×c(H+)=10-13,将pH=2的H2SO4溶液Va L与pH=12的NaOH溶液Vb L混合,pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.1mol/L,所得混合液为中性,则:Va L×0.01mol/L=Vb L×0.1mol/L,整理可得:Va:Vb=10:1,
故答案为:10:1;
②根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),溶液中c(OH-)=10-7mol/L,溶液中c(CH3COO-)=c(Na+)=$\frac{1}{2}$×0.02mol•L-1=0.01mol•L-1,故混合后溶液中c(CH3COOH)=$\frac{1}{2}$×cmol•L-1-0.01mol•L-1=(0.5c-0.01)mol/L,CH3COOH的电离常数Ka=$\frac{1{0}^{-7}×0.01}{\frac{c}{2}-001}$=$\frac{2×1{0}^{-9}}{c-0.02}$mol•L-1,
故答案为:$\frac{2×1{0}^{-9}}{c-0.02}$mol•L-1;
(2)①CuS沉淀溶解产生Cu2+和S2-,溶解平衡为:CuS2(s)?Cu2+(aq)+2S2-(aq),故答案为:CuS2(s)?Cu2+(aq)+2S2-(aq);
②溶液中c(S2-)=$\frac{{K}_{sp}}{c(C{u}^{2+})}$=$\frac{9.0×1{0}^{-36}}{0.01}$=9×10-34mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×1{0}^{-22}}{9×1{0}^{-34}}}$mol/L=3.33×105mol/L,氢离子浓度较大,说明CuS在一般酸中不能溶解,
故答案为:3.33×105mol/L;不能.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、难溶物溶解平衡的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握难溶物溶解平衡及其影响因素,试题培养了学生的分析、理解能力及化学计算能力.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 光导纤维的主要成分是氧化物 | |
| B. | 由石英玻璃拉制成细丝的过程是化学变化 | |
| C. | 光导纤维是利用激光传输信息的 | |
| D. | 光纤通信不容易受外界干扰,能够传播得更远 |
| A. | 将58.5gNaCl溶于1L水中可得1mol/L的NaCl溶液 | |
| B. | 将标准状况下22.4LHCl溶于1L水中可得1mol/L盐酸 | |
| C. | 将 25.0g胆矾溶于水后配成100mL溶液所得溶液浓度为1mol/L | |
| D. | 将 78gNa2O2溶于水,配成1L溶液可得到浓度为1mol/L溶液 |
| A. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | B. | 二氧化碳分子的比例模型: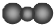 | ||
| C. | HClO的电子式: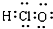 | D. | 对羟基苯甲醛的结构简式:OH- -CHO -CHO |
①少量的浓硫酸沾到皮肤上时,可用NaOH溶液中和
②取用少量化学药品时,应特别注意观察药品包装容器上的安全警示标记
③凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
④闻任何化学药品的气味时都不能使鼻子凑近药品
⑤点燃氢气前要检查纯度,以免发生爆炸
⑥CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2
⑦在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子.
| A. | ①②④⑤⑦ | B. | ②④⑤⑥⑦ | C. | ①④⑤⑥⑦ | D. | ②③④⑤⑦ |
| A. | 将40g NaOH溶解在1L水中 | |
| B. | 将22.4L HCl气体溶于水配成1L溶液 | |
| C. | 将0.1L 10 mol•L-1浓硫酸加入0.9L水中 | |
| D. | 将25g 胆矾溶于水配成100mLCuSO4溶液 |
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:
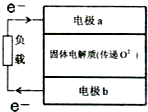
①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.