题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则:2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
C.已知氢在氯气中燃烧的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-285.8kJ/mol,所以H2(g)的燃烧热是285.8kJ·mol-1,
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
【答案】D
【解析】
A. 硫酸和氢氧化钡反应除酸碱中和放热,生成硫酸钡沉淀过程也会放热,2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) △H<114.6kJmol1,故A错误;
B. 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,选项中生成的氢气不是稳定氧化物,反应放出的热量不是甲醇的燃烧热,故B错误;
C. 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气和氯气的反应不符合燃烧热的定义,故C错误;。
D. 葡萄糖的燃烧热是1mol葡萄糖燃烧生成稳定氧化物二氧化碳和液体水放出的热量,葡萄糖的燃烧热是2800kJmol1,则热化学方程式为: ![]() C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=1400kJmol1,故D正确;
C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=1400kJmol1,故D正确;
答案选D。

【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
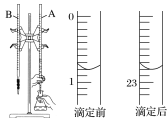
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。