题目内容
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
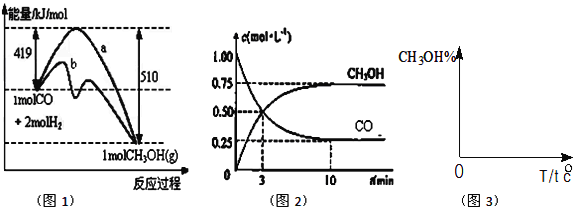
(1)在图1中,曲线_______(填:a或b)表示使用了催化剂;该反应属于_______(填:吸热、放热)反应。
(2)下列说法正确的是______________A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时 n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=________;在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在图3中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线_______________(在曲线上标出P1、P2,且P1<P2)。
(5)有一类甲醇质子交换膜燃料电池,工作时将甲醇转化为甲酸,该电池的负极反应式为_______________。
(6)已知CO、H2的燃烧热为283kJ/mol、285.8kJ/mol,写出CH3OH(g)燃烧热的热化学方程式__________________。
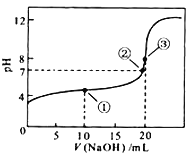
(7)常温下,用0.1000 molL-1NaOH溶液滴定20.00mL0.1000 molL-1CH3COOH溶液所得滴定曲线如图,则点①所示溶液中,关于CH3COOH、CH3COO-、H+、OH-4种微粒的等式为:____________
【答案】 b 放热 AC 0.15mol·L-1·min-1 12L2·mol-2 减小  CH3OH-4e-+H2O=HCOOH+4H+ CH3OH (g)+3/2O2(g)=CO2(g)+2H2O ΔH=-763.6kJ/mol C(CH3COOH) + 2C(H+)= C(CH3COO-) + 2C(OH-)
CH3OH-4e-+H2O=HCOOH+4H+ CH3OH (g)+3/2O2(g)=CO2(g)+2H2O ΔH=-763.6kJ/mol C(CH3COOH) + 2C(H+)= C(CH3COO-) + 2C(OH-)
【解析】(1)本题考查催化剂对活化能的影响以及焓变与能量的关系,使用催化剂降低活化能,因此曲线b表示使用催化剂,反应物的总能量大于生成物的总能量,说明此反应是放热反应;(2)本题考查勒夏特列原理和化学平衡状态的判断,A、根据图2,CO起始的浓度为1mol·L-1,则起始时通入CO的物质的量为1×2mol=2mol,故正确;B、增加CO的浓度虽然平衡向正反应方向移动,但CO总量增大,转化率降低,故错误;C、反应前后气体系数之和不相等,因此当压强不变时,说明反应达到平衡,故正确;D、再通入1molCO和2molH2,相当于在原来的基础上增大压强,平衡向正反应方向移动,n(CH3OH)增大,n(CO)的减小,因此比值增大,故错误;(3)本题考查化学反应速率计算和化学平衡常数的计算 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol·L-1) 1 2 0
变化: 0.75 1.5 0.75
平衡: 0.25 0.5 0.75 根据化学反应速率的数学表达式,v(H2)=1.5/10mol/(L·min)=0.15 mol/(L·min),根据化学平衡常数的表达式,K=c(CH3OH)/K=c(CH3OH)/[c2(H2)×c(CO)]=0.75/(0.52×0.25)=12,化学平衡常数只受温度的影响,此反应是放热反应,升高温度平衡向逆反应方向移动,即化学平衡常数减小;(4)考查影响化学平衡的因素,横坐标表示温度,升高温度,平衡向逆反应方向移动,甲醇的体积分数降低,增大压强,平衡向正反应方向移动,甲醇的体积分数增大,图像是: ;(5)考查电极反应式的书写,甲醇被氧化成甲酸,发生氧化反应,根据原电池的工作原理,负极上发生氧化反应,甲醇在负极上失电子转化成甲酸,因此电极反应式为CH3OH+H2O-4e-=HCOOH+4H+; (6)考查热化学反应方程式的计算,①CO燃烧热的热化学反应方程式为:CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1,②氢气燃烧热的热化学反应方程式:H2(g)+1/2O2(g)=H2O(l) △H-285.8kJ·mol-1,③CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1,①+2×②-③得出:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=(-283-285.8×2+91)kJ·mol-1=-763.6kJ·mol-1;(7)考查溶液中的物料守恒和电荷守恒,①加入10mLNaOH溶液,反应后溶液中的溶质为CH3COONa和CH3COOH,且两者物质的量相等,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒,c(CH3COOH)+c(CH3COO-)=2c(Na+),因此有:c(CH3COOH)+ 2c(H+)= c(CH3COO-) + 2c(OH-)。
;(5)考查电极反应式的书写,甲醇被氧化成甲酸,发生氧化反应,根据原电池的工作原理,负极上发生氧化反应,甲醇在负极上失电子转化成甲酸,因此电极反应式为CH3OH+H2O-4e-=HCOOH+4H+; (6)考查热化学反应方程式的计算,①CO燃烧热的热化学反应方程式为:CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1,②氢气燃烧热的热化学反应方程式:H2(g)+1/2O2(g)=H2O(l) △H-285.8kJ·mol-1,③CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1,①+2×②-③得出:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=(-283-285.8×2+91)kJ·mol-1=-763.6kJ·mol-1;(7)考查溶液中的物料守恒和电荷守恒,①加入10mLNaOH溶液,反应后溶液中的溶质为CH3COONa和CH3COOH,且两者物质的量相等,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒,c(CH3COOH)+c(CH3COO-)=2c(Na+),因此有:c(CH3COOH)+ 2c(H+)= c(CH3COO-) + 2c(OH-)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案