题目内容
【题目】已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+) 原来的十分之一(填“大于”、“小于”或“等于”).
(2))物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
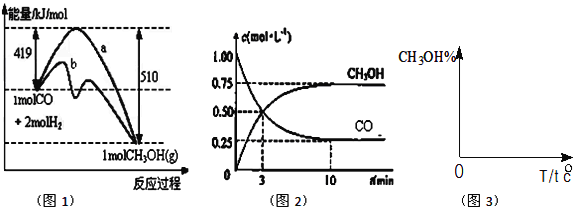
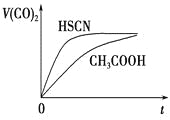
(3)25℃时,将 20mL0.1mol·L-1CH COOH 溶液和 20mL0.1mol·L-1HSCN 溶液分别与 20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反应结束后,假设 NaHCO3 完全反应且气体全部逸出,则所得两溶液中,c(CH3COO-) _c(SCN-)(填“>”、“<”或“=”;)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)―c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为 __________
【答案】(1)H2CO3 ![]() HCO3-+H+;大于;(2)e<a<d<c<b;(3)同浓度的HSCN比CH3CHOOH酸性强,与NaHCO3溶液反应快,<;(4)10-6-10-8;(5)CO2+H2O+ClO-=HCO3-+HClO。
HCO3-+H+;大于;(2)e<a<d<c<b;(3)同浓度的HSCN比CH3CHOOH酸性强,与NaHCO3溶液反应快,<;(4)10-6-10-8;(5)CO2+H2O+ClO-=HCO3-+HClO。
【解析】
试题分析:(1)碳酸是二元弱酸,要分步电离,第一步电离为主,因此主要电离方程式为:H2CO3 ![]() HCO3-+H+;加水稀释促进电离,因此稀释后c(H+)>原来的十分之一;(2)根据电离平衡常数,电离出H+能力:HSCN>CH3COOH>H2CO3>HClO>HCO3-,根据盐类水解规律,越弱越水解,因此pH由小到大的顺序是:e<a<d<c<b;(3) 同浓度的HSCN比CH3CHOOH酸性强,,与NaHCO3溶液反应快;两者恰好完全反应,生成溶质为CH3COONa、NaSCN,醋酸的酸性弱于HSCN,CH3COO-的水解程度大于SCN-的水解程度,即C(CH3COO-)<c(SCN-);(4)根据电荷守恒,c(Na+)+c(H+)=C(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6-10-8;(5)根据(2)的分析,离子反应方程式为:CO2+H2O+ClO-=HCO3-+HClO。
HCO3-+H+;加水稀释促进电离,因此稀释后c(H+)>原来的十分之一;(2)根据电离平衡常数,电离出H+能力:HSCN>CH3COOH>H2CO3>HClO>HCO3-,根据盐类水解规律,越弱越水解,因此pH由小到大的顺序是:e<a<d<c<b;(3) 同浓度的HSCN比CH3CHOOH酸性强,,与NaHCO3溶液反应快;两者恰好完全反应,生成溶质为CH3COONa、NaSCN,醋酸的酸性弱于HSCN,CH3COO-的水解程度大于SCN-的水解程度,即C(CH3COO-)<c(SCN-);(4)根据电荷守恒,c(Na+)+c(H+)=C(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6-10-8;(5)根据(2)的分析,离子反应方程式为:CO2+H2O+ClO-=HCO3-+HClO。

 通城学典默写能手系列答案
通城学典默写能手系列答案