题目内容
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
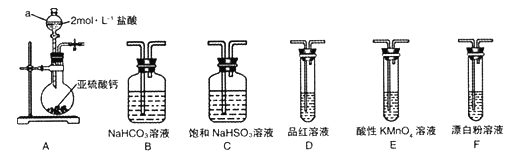
(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
【答案】 分液漏斗 SO2+2H2S=3S↓+2H2O (沉淀符号可标也可不标)
或 SO2+2Na2S+2H2O=3S↓+4NaOH (或其它合理答案) 二氧化硫通入次氯酸钙溶液发生了氧化还原反应,不能证明强酸制备弱酸的原理 B→E→D 装置D中品红溶液不褪色,F中出现白色沉淀 除去HC1气体以免影响后面的实验 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 6.4 偏低
【解析】 (1). 装置A中仪器a的名称为分液漏斗。若利用装置A中产生的气体SO2证明+4价的硫元素具有氧化性,可以将其通入盛有硫化氢气体的集气瓶中或盛有氢硫酸的试剂瓶中,分别生成淡黄色固体即可证明,化学方程式表示该实验方案的反应原理为SO2+2H2S=3S↓+2H2O。
(2). 选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①若按A→C→F→尾气处理顺序连接装置不能证明亚硫酸和次氯酸的酸性强弱,理由是二氧化硫通入次氯酸钙溶液发生了氧化还原反应,二氧化硫被氧化为硫酸根进一步与钙离子结合成微溶物硫酸钙沉淀而不是发生复分解反应生成亚硫酸钙沉淀和次氯酸,所以不能证明强酸制备弱酸的原理。
②欲证明亚硫酸的酸性强于次氯酸的酸性,根据给定装置的特点,可以先用二氧化硫通入饱和亚硫酸氢钠溶液中除去其中的氯化氢杂质,然后通入碳酸氢钠溶液反应生成二氧化碳气体,再用酸性高锰酸钾溶液除去二氧化碳气体中剩余的二氧化硫,经品红溶液检验二氧化硫已除尽,最后通入漂白粉溶液,若出现白色沉淀,证明碳酸的酸性比次氯酸强,从而间接地证明亚硫酸的酸性比次氯酸强。所以丙同学设计的合理实验方案为:按照A→C→B→E→D→F→尾气处理顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是装置D中品红溶液不褪色,F中出现白色沉淀。
③NaHSO3是一种弱酸的酸式盐,溶于水后电离出的亚硫酸氢根能发生电离:
HSO3- ![]() H++SO32-,还能发生水解:HSO3- +H2O
H++SO32-,还能发生水解:HSO3- +H2O![]() H2SO3+OH-。HSO3-无论是电离还是水解其程度都是很小的。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,说明亚硫酸氢根的电离程度大于其水解程度,由于水也能电离出H+,则该溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
H2SO3+OH-。HSO3-无论是电离还是水解其程度都是很小的。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,说明亚硫酸氢根的电离程度大于其水解程度,由于水也能电离出H+,则该溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
(3). 20.00 mL0.0500 mol/L的KMnO4溶液中
n(KMnO4)=20.00![]() 10-3L
10-3L![]() 0.0500mol/L=1.000
0.0500mol/L=1.000![]() 10-3mol
10-3mol
由10I- ~ 2 MnO4- 可求出与KI标准溶液反应的KMnO4的物质的量为:
n1(KMnO4)= ![]() n(I-)=
n(I-)= ![]()
![]() 15.00
15.00![]() 10-3L
10-3L![]() 0.2000mol/L=6.000
0.2000mol/L=6.000![]() 10-4mol
10-4mol
所以与SO2反应的KMnO4的物质的量为:n2(KMnO4)=n- n1=4.000![]() 10-4mol
10-4mol
由5SO2~2MnO4-可求出10.00mL残液中:n(SO2)=![]() n2(KMnO4)=1.000
n2(KMnO4)=1.000![]() 10-3mol
10-3mol
m(SO2)= 1.000![]() 10-3mol
10-3mol![]() 64g/mol=6.400
64g/mol=6.400![]() 10-2g
10-2g
所以①残液中SO2的含量为![]() =6.400g·L-1。
=6.400g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,相当于剩余的高锰酸钾偏多,与二氧化硫反应的高锰酸钾偏少,使测定结果偏低。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案