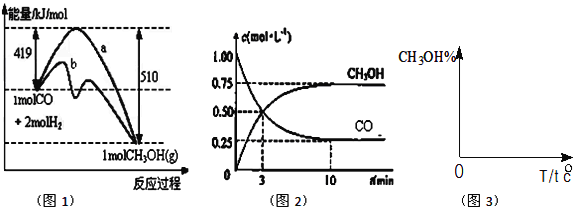
题目内容
【题目】材料科学发展日新月异。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____________。某镍配合物结构如图5所示,分子内含有的作用力有_______________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(2)某金属M与C60可制备一种超导材料,晶胞如图1所示,M原子位于晶胞的棱上与内部。该材料的化学式为__________________。
(3)碳的一种同素异形体——石墨,其晶体结构如图2所示,碳原子的杂化方式_____________,图3虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________________个。
(4)有机太阳能固体电池材料含有高纯度C60,其结构如图4,1molC60分子中π键的数目为_______,C60的晶胞结构如图4,则一个C60分子周围有_________个紧邻C60分子,其固体属于___________晶体。C60能在溶剂二硫化碳中溶解而不溶于水的原因是_________________。已知该晶胞的密度为ρ g·cm-3则两个最近C60间的距离为_________________nm(列出计算式,已知阿伏伽德罗常数的值为NA)。
【答案】 3d84s2 :ACE M3C60 sp2 4 30NA 12 分子 C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子  ×107
×107
【解析】本题考查《物质结构与性质》,(1)Ni位于VIII族,即Ni的价电子包括最外层电子和次外层的d能级,Ni的价电子排布式为3d84s2,根据图5的Ni和N之间存在配位键,N=C、C-C、N-O、C-H、O-H之间是共价键或极性共价键,O…H之间存在氢键,故选项ACE正确;(2)C60位于晶胞的顶点和面心,个数为8×1/8+6×1/2=4,M位于棱上和体心,个数为12×1/4+9=12,化学式为M3C60;(3)根据图2,石墨中碳原子形成3个C-C,无孤电子对,因此杂化类型为sp2,根据图3碳原子位于顶点、棱上、面心、体心,因此个数为8×1/8+4×1/4+1+2×1/2=4;(4)C60中一个碳原子有2个C-C,1个C=C,根据均摊法,1个碳原子有1/2个π键,1molC60中含有π键的数目是60×1/2×NA=30NA,C60属于分子晶体,一个C60分子周围有12个紧邻的C60,C60与二氧化硫都是非极性分子,相似相溶,而水是极性分子;C60的晶胞与干冰的晶胞相似,设棱长为acm,晶胞的质量为(8×1/8+6×1/2)×720/NAg=2880/NAg,晶胞的体积为a3cm3,根据密度的定义,ρ=2880/NA a3,a=  ,两个最近C60间距离是面心对角线的一半,即
,两个最近C60间距离是面心对角线的一半,即![]() ×
× ×107nm。
×107nm。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案