��Ŀ����
��14�֣���ҵ����������β���ŷų���SO2��NOx�ȣ����γ���������Ҫ���ء������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��____________________��
��2����֪2SO2 (g)+ O2 (g) 2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
��T�¶�ʱ����2L�ݻ��̶�������ܱ������м���2.0 mol SO2��1.0 mol O2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%�����(O2)��____________��
���ڢٵ������£��жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______(����ĸ)��
E��SO2���������ʺ�SO3�������������
������Ӧ��ʼʱ���������м���1.5 mol SO2��0.8 mol O2����ƽ�����������ת���� ������ת���ʣ�����ڡ�С�ڻ���ڣ���
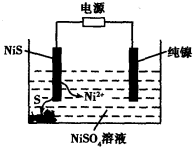
��3�������е�SO2������NaOH��Һ���գ������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ�����缫����Ϊʯī��
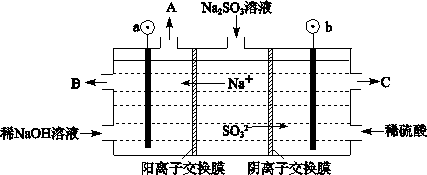
��ͼ��a��Ҫ���ӵ�Դ�ģ������������_______����C��������������_______��
��SO32���ŵ�ĵ缫��ӦʽΪ_____________________________________��
�۵�������������12.6gNa2SO3�����������仯������Ϊ_______g(����ù���������Һ��������ܱ�)��
��1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��____________________��
��2����֪2SO2 (g)+ O2 (g)
 2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ����T�¶�ʱ����2L�ݻ��̶�������ܱ������м���2.0 mol SO2��1.0 mol O2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%�����(O2)��____________��
���ڢٵ������£��жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______(����ĸ)��
| A��SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 | B�������������ѹǿ���� |
| C�������ڻ��������ܶȱ��ֲ��� | D��SO3�����ʵ������ٱ仯 |
������Ӧ��ʼʱ���������м���1.5 mol SO2��0.8 mol O2����ƽ�����������ת���� ������ת���ʣ�����ڡ�С�ڻ���ڣ���
��3�������е�SO2������NaOH��Һ���գ������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ�����缫����Ϊʯī��

��ͼ��a��Ҫ���ӵ�Դ�ģ������������_______����C��������������_______��
��SO32���ŵ�ĵ缫��ӦʽΪ_____________________________________��
�۵�������������12.6gNa2SO3�����������仯������Ϊ_______g(����ù���������Һ��������ܱ�)��
��1��2SO2+2H2O+O2=2H2SO4 ��2����0.05mol/(L��min) �� BDE �۴���
��3���ٸ� ���� �� SO32���C2e����H2O��SO42��+2H+ ��4.4
��3���ٸ� ���� �� SO32���C2e����H2O��SO42��+2H+ ��4.4
�����������1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��2SO2+2H2O+O2=2H2SO4 ����2�����ڷ�Ӧ��ʼʱn(SO2) =2mol��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%����Ӧ���ĵ�SO2�����ʵ���Ϊ1mol,��Ϊ�ڷ�ӦʱSO2�� O2�ǰ���2:1���ĵģ����Է�Ӧ�����������ʵ���Ϊ0.5mol,��˦�(O2)��0.5mol��2L��5 min=0.05mol/(L��min)����A���ڷ�Ӧ��SO2��O2��SO3�ǰ���2:1:2�Ĺ�ϵ�仯�ģ����Ǵﵽƽ��ʱ���ǵĹ�ϵ���ܷ�������������Ҳ���ܲ����ϡ���˲�����Ϊƽ��ı�־������B�����ڸ÷�Ӧ�ķ�Ӧǰ������������ȣ����ﵽƽ�⣬�������������ʵ������䣬ѹǿҲ���䡣��������������ѹǿ���������Ϊ�ж�ƽ��ı�־����ȷ��C�������������ݻ����䣬��Ӧ�ַ��������غ㶨�ɣ��������۷�Ӧ���е�ʲô�̶ȣ������ڻ��������ܶȶ����ֲ��䣬�ʲ�����Ϊ�ж�ƽ��ı�־������D������Ӧ�ﵽƽ�⣬�κ�һ�����ʵ����ʵ��������䣬Ũ��Ҳ���䣬���SO3�����ʵ������ٱ仯������Ϊ�ж�ƽ��ı�־����ȷ��E��ÿ����1��SO2�ͻ�ͬʱ����1��SO3�����ڵ�SO2�������ʺ�SO3������������ȣ���SO2�������ʺ�SO2������������ȣ���Ӧ�ﵽƽ�⡣��˿���Ϊ�ж�ƽ��ı�־ ����ȷ��������Ӧ��ʼʱ���������м���1.5 mol SO2��0.8 mol O2��n(SO2):n(O2)<2:1,���������˵����������ƽ�����������ת���ʴ���������ת���ʡ���3������ͼ������Na+��a�������ƶ�������ͬ�ֵ����ų⣬���ֵ���������ԭ��aҪ���ӵ�Դ�ĸ�����b���ӵ�Դ����������������SO32�����Ϸŵ��ΪSO42������˴�C�����������������ᡣ��SO32���ŵ�ĵ缫��ӦʽΪSO32���C2e����H2O��SO42��+2H+���۵�������������12.6gNa2SO3��n(Na2SO3)= 12.6g��126g/mol=0.1mol,�����ת��0.2mol,������������Ӧ��2H++2e-=H2��.�ų�����0.1mol,��������0.2g,ͬʱ���������0.2mold Na+,����Һ����4.6g,�ʸ����������������4.4g��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
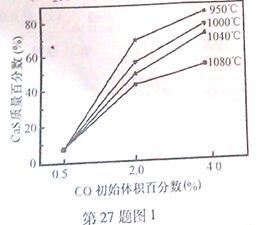
 CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��)
CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��) 
 CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺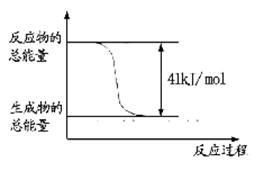
 д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ__ _��
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ__ _��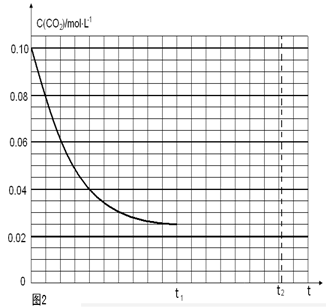

 ��_________���ƶ���
��_________���ƶ���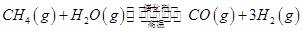 ��һ���¶��£���2 L�ݻ�������ܱ������г���4 mol
��һ���¶��£���2 L�ݻ�������ܱ������г���4 mol 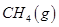 ��6 mo1 H2O(g)������Ӧ��10 minʱ����Ӧ�ﵽƽ��״̬�����CH4(g)��H2(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��
��6 mo1 H2O(g)������Ӧ��10 minʱ����Ӧ�ﵽƽ��״̬�����CH4(g)��H2(g)�����ʵ�����ʱ��仯��������ͼ��ʾ��
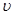 (CO)��ʾ�Ļ�ѧ��Ӧ����Ϊ_________��
(CO)��ʾ�Ļ�ѧ��Ӧ����Ϊ_________��
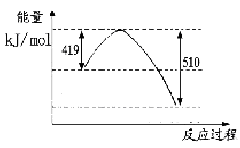
 2SO3(g)����H��0
2SO3(g)����H��0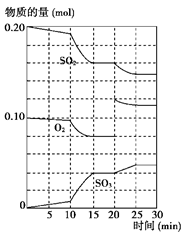
 Ni��CO��4��g��
Ni��CO��4��g��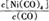 ������?H 0���>����<������
������?H 0���>����<������
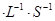 ��
�� )
)
 4NO��6H2O�����ڷ�Ӧ��ʼ��5s��10s֮��ķ�Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ���������ж���ȷ�Ĺ�ϵ��(����)��
4NO��6H2O�����ڷ�Ӧ��ʼ��5s��10s֮��ķ�Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ���������ж���ȷ�Ĺ�ϵ��(����)��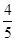 v(NH3)��v(O2)
v(NH3)��v(O2) 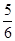 v(O2)��v(H2O)
v(O2)��v(H2O)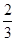 v(NH3)��v(H2O)
v(NH3)��v(H2O)