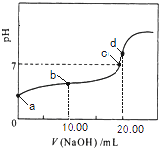
题目内容
【题目】在一密闭容器中发生反应N2+3H22NH3 , 达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: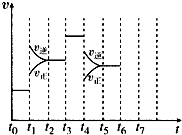
回答下列问题:
(1)处于平衡状态的时间段是(填选项).
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻;t3时刻;
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是(填选项).
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 .
【答案】
(1)ACDF
(2)C;E
(3)A
(4)5:6
【解析】解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,所以答案是:ACDF;(2)由N2(g)+3H2(g)2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3时正逆反应速率均增大,且逆反应速率等于正反应速率,改变条件应为加催化剂,所以答案是:C;E;(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,所以答案是:A;(4)设反应前加入a mol N2 , bmol H2 , 达平衡时生成2x mol NH3 , N2(g)+3H2(g)2NH3(g)
起始 a b0
转化 x 3x2x
平衡 a﹣x b﹣3x 2x
则反应后气体总的物质的量=(a+b﹣2x)mol, ![]() =0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=
=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比= ![]() =
= ![]() =
= ![]() ,所以答案是:5:6.
,所以答案是:5:6.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

【题目】按照物质的树状分类和交叉分类,HNO3应属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥强酸 ⑦一元酸 ⑧化合物 ⑨混合物
A. ①②③④⑤⑥⑦⑧B. ①④⑥⑦⑧
C. ①⑨D. ①④⑤⑥⑦
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为 _________________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到______________(填现象) |
(2)综合上述实验现象和结论,______(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是__________________________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________________________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点________(填“正确”或“错误”),原因是_________________________________________________________。