题目内容
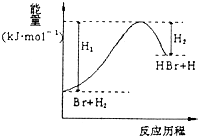
【题目】(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成1mo1NH3(g)过程中能量变化示意图,

请写出N2和H2反应的热化学方程式:_____________________________;
(2)若已知下列数据:
化学键 | H-H | N≡N |
键能/kJmol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能______kJmol-1
(3)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式________________________________;
(4)已知1克氢气完全燃烧生成液态水时放出akJ的热量,请写出表示氢气燃烧热的热化学方程式____________________________________________。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) ΔH=92kJ·mol-1 390 1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH-573 kJ·mol-1 H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1
2NH3(g) ΔH=92kJ·mol-1 390 1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH-573 kJ·mol-1 H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1
【解析】考查热化学反应方程式的书写、燃烧热的定义,(1)根据能量与反应过程的图像,反应物总能量大于生成物的总能量,此反应是放热反应,△H=(254-300)kJ·mol-1=-46kJ·mol-1,1/2N2(g)+3/2H2(g)![]() NH3(g) △H=-46kJ·mol-1,或者是N2(g)+3H2(g)
NH3(g) △H=-46kJ·mol-1,或者是N2(g)+3H2(g)![]() 2NH3(g) ΔH=92kJ·mol-1 ;(2)令N-H的键能为xkJ·mol-1,根据反应热=反应物键能总和-生成物键能总和=943+3×435-6×x=-92kJ·mol-1,解得x=390kJ·mol-1;(3)根据中和热的定义,生成1molH2O放出的热量为5.73/(100×10-3×1)kJ=57.3kJ,中和热的热化学反应方程式为1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH=-573 kJ·mol-1;(4)根据燃烧热的定义,1molH2完全燃烧放出的热量为2akJ,氢气燃烧热的热化学反应方程式为H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1。
2NH3(g) ΔH=92kJ·mol-1 ;(2)令N-H的键能为xkJ·mol-1,根据反应热=反应物键能总和-生成物键能总和=943+3×435-6×x=-92kJ·mol-1,解得x=390kJ·mol-1;(3)根据中和热的定义,生成1molH2O放出的热量为5.73/(100×10-3×1)kJ=57.3kJ,中和热的热化学反应方程式为1/2H2SO4(aq)+NaOH(aq)= 1/2Na2SO4(aq)+H2O(l) ΔH=-573 kJ·mol-1;(4)根据燃烧热的定义,1molH2完全燃烧放出的热量为2akJ,氢气燃烧热的热化学反应方程式为H2(g)+1/2O2(g)=H2O(l) ΔH=-2a kJ·mol-1。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是________;表示反应中和热ΔH=-57.3 kJ·mol-1的是________(填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+![]() O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | a | 360 | 500 | 434 |
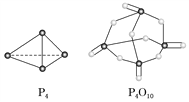
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=________(保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:_______________________________。