题目内容
将pH=3的某弱酸溶液稀释100倍后,该溶液的pH值范围为:____>pH>____;其原因是____。
5>pH>3;弱酸稀释时,[H+]的变小程度要大于强酸中[H+]变化。
可设定该溶液为强酸溶液,题中pH=3,即强酸溶液中[H+]=10-3 mol·L-1。当稀释100倍后,[H+]=10-5mol·L-1,即pH=5。
而题中该酸为弱酸,有电离度,存在着电离平衡,虽然溶液pH=3,即[H+]=10-3mol·L-1,但其溶质的物质的量浓度应远远超过[H+]。稀释100倍后,如果不考虑弱酸电离度变化,[H+]也应是10-5 mol·L-1。实际上随水的加入稀释,弱酸的电离度还会变大,导致没有电离的弱酸会继续电离,又会使[H+]>105mol·L-1,即pH<5。
而题中该酸为弱酸,有电离度,存在着电离平衡,虽然溶液pH=3,即[H+]=10-3mol·L-1,但其溶质的物质的量浓度应远远超过[H+]。稀释100倍后,如果不考虑弱酸电离度变化,[H+]也应是10-5 mol·L-1。实际上随水的加入稀释,弱酸的电离度还会变大,导致没有电离的弱酸会继续电离,又会使[H+]>105mol·L-1,即pH<5。

练习册系列答案
相关题目
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)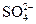 )=______________。
)=______________。
