题目内容
试计算下列溶液的pH(均在25 ℃时):
(1)0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液等体积相混后溶液的pH为_____。
(2)将0.1 mol·L-1盐酸与0.6 mol·L-1Ba(OH)2溶液等体积相混后溶液的pH为________。
(3)将0.1 mol·L-1的稀H2SO4稀释1010倍后,溶液中c(H+)∶c(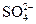 )=______________。
)=______________。
(1)0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液等体积相混后溶液的pH为_____。
(2)将0.1 mol·L-1盐酸与0.6 mol·L-1Ba(OH)2溶液等体积相混后溶液的pH为________。
(3)将0.1 mol·L-1的稀H2SO4稀释1010倍后,溶液中c(H+)∶c(
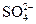 )=______________。
)=______________。(1)14-lg6.67 (2)12 (3)105∶1
两种强碱相混的pH计算步骤为:先求c混(OH-)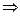 c混(H+)
c混(H+)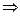 pH。
pH。
c混(OH-)= ="0.15" mol·L-1
="0.15" mol·L-1
c混(H+)=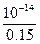 =6.67×10-14 mol·L-1,pH=14-lg6.67。
=6.67×10-14 mol·L-1,pH=14-lg6.67。
(2)先判断酸、碱谁过量:盐酸中n(H+)=0.1V(mol),Ba(OH)2中n(OH-)=0.06×2×V="0.12V" mol,可见碱过量。
碱过量时,先算出c混(OH-)=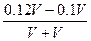 ="0.01" mol·L-1
="0.01" mol·L-1
故c混(H+)=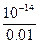 =10-12 mol·L-1,故pH=12
=10-12 mol·L-1,故pH=12
(3)令稀H2SO4为1 L,则n(H2SO4)="0.1" mol,n(H+)="0.2" mol,n(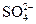 )="0.1" mol,稀释后:c(
)="0.1" mol,稀释后:c(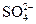 )=
)=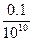 =10-11 mol·L-1,c(H+)=
=10-11 mol·L-1,c(H+)=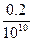 =2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。
=2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。
故:c(H+)∶c(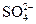 )=10-7∶10-12=105∶1。
)=10-7∶10-12=105∶1。
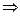 c混(H+)
c混(H+)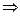 pH。
pH。c混(OH-)=
 ="0.15" mol·L-1
="0.15" mol·L-1c混(H+)=
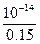 =6.67×10-14 mol·L-1,pH=14-lg6.67。
=6.67×10-14 mol·L-1,pH=14-lg6.67。(2)先判断酸、碱谁过量:盐酸中n(H+)=0.1V(mol),Ba(OH)2中n(OH-)=0.06×2×V="0.12V" mol,可见碱过量。
碱过量时,先算出c混(OH-)=
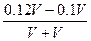 ="0.01" mol·L-1
="0.01" mol·L-1故c混(H+)=
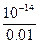 =10-12 mol·L-1,故pH=12
=10-12 mol·L-1,故pH=12(3)令稀H2SO4为1 L,则n(H2SO4)="0.1" mol,n(H+)="0.2" mol,n(
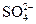 )="0.1" mol,稀释后:c(
)="0.1" mol,稀释后:c(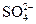 )=
)=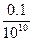 =10-11 mol·L-1,c(H+)=
=10-11 mol·L-1,c(H+)=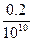 =2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。
=2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。故:c(H+)∶c(
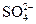 )=10-7∶10-12=105∶1。
)=10-7∶10-12=105∶1。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
