题目内容
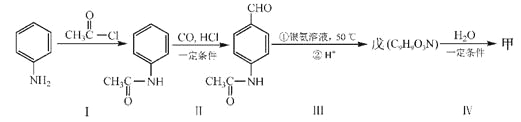
【题目】硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要含Al、A12O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有______。
a.容量瓶 b.量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是______。
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、______、过滤、______、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因______。
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
氢氧化物 | Fe(OH)3 | Al(OH)3 |
开始沉淀pH | 1.9 | 4.2 |
沉淀完全pH | 3.2 | 5.4 |
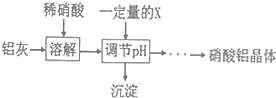
调节pH的目的是______,为使得到的硝酸铝晶体较纯净,所用的X物质可以是______(填编号)。
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是______。
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为______。
【答案】b 如何控制反应终点(或硝酸的用量 冷却结晶 洗涤 产物中杂质NaNO3的含量较高 将Fe3+转化为Fe(OH)3沉淀除去 BC 产生大量污染性气体NO等 8.7
【解析】
铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体。
(1)用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,还需要量筒,故答案为:b;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解,故答案为:如何控制反应终点(或硝酸的用量);
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干,故答案为:冷却结晶、洗涤;
(4)反应Ⅱ、Ⅲ合并以简化操作,产物中杂质NaNO3的含量较高,故答案为:产物中杂质NaNO3的含量较高;
(5)铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去;加入的X能与酸反应且不能引入新杂质,故不能选氨水、偏铝酸钠,可以选择Al与氢氧化铝,故答案为:将Fe3+转化为Fe(OH)3沉淀除去;BC;
(6)Al与稀硝酸反应会生成NO,污染空气,故答案为:产生大量污染性气体NO等;
(7)硝酸铝晶体分解得到氧化铝、水,另外物质相当于N2O5,氧化铝的物质的量为![]() =0.01mol,根据Al元素守恒,硝酸铝的物质的量为0.02mol,根据N原子守恒,可知N2O5为
=0.01mol,根据Al元素守恒,硝酸铝的物质的量为0.02mol,根据N原子守恒,可知N2O5为![]() =0.03mol,其质量为0.03mol×108g/mol=3.24g,故结晶水为质量为7.392g﹣1.02g﹣3.24g=3.132g,结晶水物质的量为
=0.03mol,其质量为0.03mol×108g/mol=3.24g,故结晶水为质量为7.392g﹣1.02g﹣3.24g=3.132g,结晶水物质的量为![]() =0.174mol,故结晶水数目为
=0.174mol,故结晶水数目为![]() =8.7,故答案为:8.7。
=8.7,故答案为:8.7。

【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________