题目内容
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
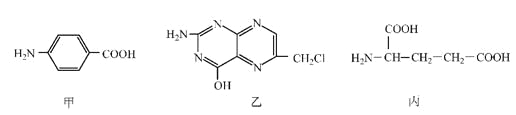
(1)甲中显酸性的官能团是_______________(填名称)。
(2)下列关于乙的说法正确的是__________________(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________________。
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
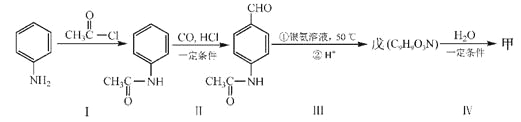
①步骤I的反应类型是______________________。
②步骤I和Ⅳ在合成甲过程中的目的是____________________。
③步骤Ⅳ反应的化学方程式为___________________________________。
【答案】羧基 a、c ![]() 取代反应 保护氨基
取代反应 保护氨基 
【解析】
(1)根据甲的结构简式(![]() )可确定其显酸性的官能团是羧基;
)可确定其显酸性的官能团是羧基;
(2) a.根据乙的结构简式( )可知,分子中碳原子与氮原子的个数比是7:5,a项正确;
)可知,分子中碳原子与氮原子的个数比是7:5,a项正确;
b.没有苯环结构,不属于芳香族化合物,b项错误;
c.含有氨基、氯原子既能与盐酸又能与氢氧化钠溶液反应,c项正确;
d.没有苯环结构,即没有酚羟基,不属于苯酚的同系物,d项错误;
综上ac正确;
(3)根据丙的结构简式( ),再结合其同分异构体的限定条件可确定其含有“
),再结合其同分异构体的限定条件可确定其含有“![]() ”、“
”、“ ”等基团,然后将二者对结得该同分异构体的结构简式为
”等基团,然后将二者对结得该同分异构体的结构简式为 ;
;
(4)①步骤I的反应为:![]() +
+![]() →
→ +HCl,属于取代反应;
+HCl,属于取代反应;
②通过对步骤I和Ⅳ的分析,在合成甲的过程中这两步的目的是保护氨基,防止其被氧化;
③根据 和戊的分子式(C9H9O3N)可确定戊的结构简式为
和戊的分子式(C9H9O3N)可确定戊的结构简式为 ,据此可写出步骤Ⅳ 反应的化学方程式为
,据此可写出步骤Ⅳ 反应的化学方程式为 。
。

【题目】硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要含Al、A12O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
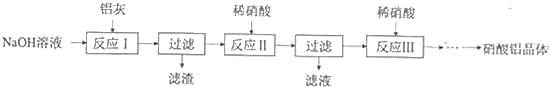
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有______。
a.容量瓶 b.量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是______。
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、______、过滤、______、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因______。
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
氢氧化物 | Fe(OH)3 | Al(OH)3 |
开始沉淀pH | 1.9 | 4.2 |
沉淀完全pH | 3.2 | 5.4 |
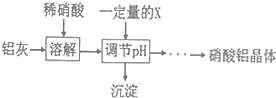
调节pH的目的是______,为使得到的硝酸铝晶体较纯净,所用的X物质可以是______(填编号)。
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是______。
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为______。
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体