题目内容
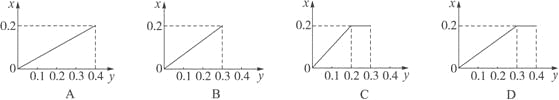
【题目】I.利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
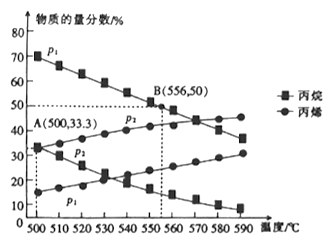
(1)反应的△H_____0(填“>”“<”“=”下同)压强P2______0.1MPa
(2)图中A点丙烷的转化率为________。
(3)若图中A、B两点对应的平衡常数用K(A)、K(B)表示,则K(A)______K(B) (填“>”“<”或“=”)。
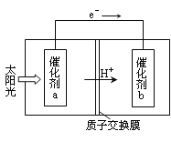
II.为摆脱对石油的过渡依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一个电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO3晶体,它在高温填能传导O2-。
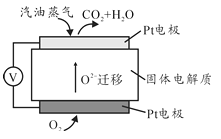
(1)以辛烷(C8H18)代替汽油.写出该电池工作时的负极反应方程式:______。
(2)己知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH______g。
Ⅲ.煤燃烧产生的CO2是造成温室效应的主要气体之一。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为原子利用率=(预期产物的总质量/全部反应物的总质量)×100%,将CO2转化成有机物可有效地实现碳循环,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2![]() C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是_______,反应d中理论上原子利用率为________。
【答案】 > < 50% < C8H1850e+25O2=8CO2+9H2O 80 a 28%
【解析】I.(1)本题考查勒夏特列原理,随着温度的升高,丙烷的物质的量分数降低,说明升高温度,平衡正向移动,正反应方向是吸热反应,即△H>0;作等温线,因反应前气体系数之和小于反应后气体系数之和,随着压强的增大,平衡向逆反应方向进行,丙烷的物质的量分数增大,根据图像推出P2<0.1Pa;(2)考查转化率的计算,令丙烷起始的物质的量amol, C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量:a 0 0
变化量:x x x
平衡量:a-x x x 图中A点达到平衡是丙烷和丙烯的物质的量分数相等,因此有(a-x)/(a+x)=x/(a+x),解得x=a/2,则丙烷的转化率为a/2a×100%=50%;(3)因为化学平衡常数只受温度的影响,此反应的正反应是吸热反应,升高温度平衡向正反应方向进行,B点温度比A点温度高,因此有 K(A)<K(B);II.考查电极反应式书写以及电化学计算,(1)电解质为固体,高温传导O2-,根据电池工作原理,通辛烷的一极为负极,辛烷中的C转变成CO2,H转变成H2O,电极反应式为C8H18+25O2--50e-=8CO2+9H2O;(2)电路中通过的电子物质的量为1.929×105/(1.602×10-19×6.02×1023)mol=2mol,阴极上产生氢氧化钠,其电极反应式为2H2O+2e-=H2↑+2OH-,因此当通过2mol电子时,产生氢氧化钠的质量为2×40g=80g;III.考查原子利用率的计算,a选项利用太阳能,其余选项都需要加热,因此最节能的是a,根据d反应方程式,生成28g乙烯的同时,还生成72g的H2O,因此原子利用率为28/(28+72)×100%=28%。

 阅读快车系列答案
阅读快车系列答案