题目内容
【题目】现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO![]() 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:_____________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)___________,理由是_______________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“能”或“否”)__________。若改用甲基橙作指示剂则实验结果_______________(填“偏大”、“偏小”或“不变”)。
(4)根据上述实验数据,写出计算NaOH纯度的表达式
__________________________________。
【答案】 溶液由浅红色变为无色,并且30 s内无变化 否 指示剂变色前,混合液呈碱性,所加盐酸只与NaOH反应,而不与BaCO3反应 否 偏大 ![]() ×100%
×100%
【解析】(1)混合溶液中为氢氧化钠和氯化钠溶液呈碱性,滴入酚酞溶液为红色,滴入盐酸反应到终点,滴入最后一滴盐酸溶液红色恰好退去且半分钟不变化,证明反应达到终点;
(2)酚酞的变色范围是8~10,溶液显弱碱性,此时BaCO3不溶解,所以向混有BaCO3沉淀的NaOH溶液中滴加盐酸,不会使BaCO3溶解从而能测定NaOH的含量;
(3)甲基橙变色的pH范围为3.1-4.4,若改用甲基橙作指示剂,滴定至终点时,溶液呈酸性,BaCO3溶解,消耗的盐酸偏多,故检测的结果偏高,所以不能用甲基橙作指示剂;
(4)参加反应的HCl的物质的量为c mol·L-1×V ×10-3L=,则样品中NaOH纯度=(Vc×10-3mol×40g/mol)÷ag×100%=![]() ×100%;
×100%;

 口算题天天练系列答案
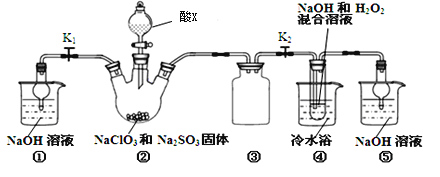
口算题天天练系列答案【题目】卤素单质都是重要的化工原料。其课外小组在实验室完成了下列有关卤素单质的实验。
(1)设计以下装置(夹持装置已略去),进行实验,模拟海水提溴的部分过程。

①a是一种黄绿色气体。A装置中通入a气体的目的是____________________(用离子方程式表示)。
②A装置中通入a气体一段时间后,停止通入,改通入热空气。通入热空气的目的是____________________。
③反应过程中,B装置中有SO42-生成。则气体b的化学式是____________________。检验B装置的溶液中含有SO42-的方法是______________________________。
④C装置的作用是________________________________________。
⑤该小组同学向反应后B装置的溶液中通入a气体,充分反应得到混合液。一位同学根据溴的沸点是59℃,提出采用__________方法从该混合液中分离出溴单质;另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,该过程中应用的方法包括______________________________。
(2)设计实验:比较C12、Br2、I2三种单质的氧化性强弱。实验记录如下:
实验步骤 | Ⅰ
| Ⅱ
| Ⅲ
|
实验现象 | 溶液变为黄色 | 溶液变为黄色 | 溶液变为蓝色 |
实验结论 | 氧化性:Cl2>Br2 | 氧化性:Br2>I2 | |
①你认为上述实验设计(填“”或“不能”__________达到实验目的,理由是______________________________。
②Cl2、Br2、I2三种单质氧化性的递变性,用原子结构解释原因:________________________________________。
【题目】当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
(1)已知:H2O(g)=H2O(l) △H=-44 kJ·mol-1
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ·mol-1 | 285.8 | 393.5 | 283.0 |
⑴请写出煤的气化反应生成合成气(CO和H2)的热化学方程式_______。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氧键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃枓。工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主反应如下:
CO2(g)+3H2(g)![]() CH3OH (g) +H2O(g) △H=-58kJ/mol
CH3OH (g) +H2O(g) △H=-58kJ/mol
①请推断该反应自发进行的条件为____________
②若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应。测得CH3OH的物质的量随时间的变化如图所示。
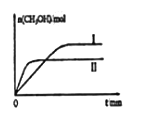
曲线I、II对应的平衡常数大小关系为KI__KII(填“>”或“=”或“<”);若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为___;若容器容积不变,下列措施可增加甲醇产率的是_____。
a.升高温度b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
(3)CH4燃料电池利用率很高,装置中添加1L 2 mol·L-1 的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为_________________。