题目内容
【题目】将22.4 g 铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是

【答案】C
【解析】试题分析:Fe与稀硝酸反应n(Fe)="22.4/56=0.4" mol,设稀HNO3完全反应,消耗Fe为xmol,设生成Fe(NO3)3为y mol据反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O得,x=0.2mol,Fe过量(0.4-0.2)=0.2mol,继续加入Fe粉,不再产生NO气体,过量的铁与Fe(NO3)3发生反应,Fe+2Fe(NO3)33Fe(NO3)2,完全反应还只需加0.1molFe ,A、生成0.2mol气体需用0.2mol铁,A项错误;B、生成0.2mol气体需用0.2mol铁,B项错误;C、据以上分析,C项正确;D、生成0.2mol气体需用0.2mol铁,D项错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
(1)已知:H2O(g)=H2O(l) △H=-44 kJ·mol-1
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ·mol-1 | 285.8 | 393.5 | 283.0 |
⑴请写出煤的气化反应生成合成气(CO和H2)的热化学方程式_______。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氧键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃枓。工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主反应如下:
CO2(g)+3H2(g)![]() CH3OH (g) +H2O(g) △H=-58kJ/mol
CH3OH (g) +H2O(g) △H=-58kJ/mol
①请推断该反应自发进行的条件为____________
②若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应。测得CH3OH的物质的量随时间的变化如图所示。
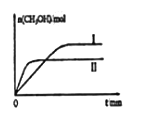
曲线I、II对应的平衡常数大小关系为KI__KII(填“>”或“=”或“<”);若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为___;若容器容积不变,下列措施可增加甲醇产率的是_____。
a.升高温度b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
(3)CH4燃料电池利用率很高,装置中添加1L 2 mol·L-1 的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为_________________。
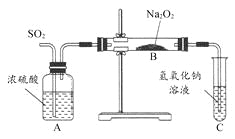
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。