题目内容
【题目】有机物H(结构简式为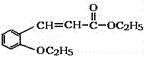 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
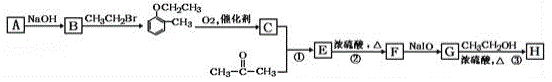
已知:①![]()
②
请回答下列问题:
(1)A的化学名称为_______________,G中所含官能团的名称是________________________;①和②的反应类型分别是______________、__________________。
(2)检验有机物A 中官能团的方法为__________________________________。
(3)高分子化合物M 的结构简式为__________________。
(4)反应③的化学反应方程式为__________________________________。
(5)有机物C 有多种同分异构体,其中属于芳香羧酸类的同分异构体有___________种。
【答案】 2﹣甲基苯酚或邻甲基苯酚 碳碳双键、羧基、醚键 加成反应 消去反应 取有机物A少许于试管中,滴加氯化铁溶液,溶液显紫色 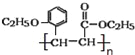
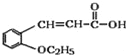 +CH3CH2OH
+CH3CH2OH![]()
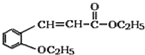 +H2O 14
+H2O 14
【解析】有机物A分子式为C7H8O,所以,A为邻甲基苯酚,与溴乙烷发生取代反应生成醚,根据信息可知,该有机物CH3CH2O-C6H5-CH3 中甲基被氧气氧化为醛基,变为有机物C:CH3CH2O-C6H5-CHO,然后该物质与丙酮发生加成反应变为羟基酮E,E在浓硫酸作用下,加热发生消去反应生成烯醛F,最后烯醛F被NaIO氧化为含有羧酸的有机物G,最后有机物G与乙醇发生酯化反应生成酯(H)。
(1)通过以上分析可知:A为含有羟基和甲基的芳香化合物,化学名称为邻甲基苯酚,通过有机物G的结构可知所含官能团的名称是碳碳双键、羧基、醚键;醛和酮发生加成反应生成含有羟基、酮羰基的有机物E,然后E在浓硫酸、加热条件下发生消去反应,正确答案:2﹣甲基苯酚或邻甲基苯酚;碳碳双键、羧基、醚键; 加成反应;消去反应。
(2)检验有机物A 中含有羟基,检验方法可用氯化铁溶液,溶液显紫色;或浓溴水,产生白色沉淀;正确答案:取有机物A少许于试管中,滴加氯化铁溶液,溶液显紫色。
(3)有机物H(结构简式为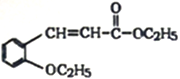 )是合成高分子化合物M的单体,所以有机物H通过加聚反应可以生成M,其结构简式为
)是合成高分子化合物M的单体,所以有机物H通过加聚反应可以生成M,其结构简式为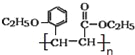 ;正确答案:
;正确答案: 。
。
(4)含有羧酸的有机物G,与乙醇在浓硫酸加热条件下发生酯化反应生成酯(H),方程式如下: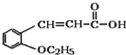 +CH3CH2OH
+CH3CH2OH![]()
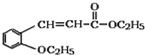 +H2O;正确答案:
+H2O;正确答案: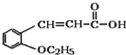 +CH3CH2OH
+CH3CH2OH![]()
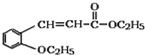 +H2O。
+H2O。
(5)有机物C 分子式为C9H10O2,属于芳香羧酸,一定含有-COOH,因此符合条件的有机物可能有:含有-CH2-CH2-COOH与苯环直接相连,有1种; 含有 -CH(CH3)-COOH与苯环直接相连,有1种; 苯环上连有1个-CH2COOH和1个 -CH3 ,共有3种; 苯环上连有1个-COOH和1个-CH2-CH3 ,有3种;苯环上连有1个-COOH和2个-CH3 ,有6种,最后共计有14种;正确答案:14。

【题目】已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣5 akJmol﹣1则O﹣H的键能为( )
共价健 | N﹣N | N﹣H | O=O | N≡N |
键能kJmol﹣1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol﹣1
B.2.5a kJmol﹣1
C.3a kJmol﹣1
D.3.5a kJmol﹣1